アデノウイルス・ワクチン
アデノウイルス(adenovirus)を利用した治療薬の代表は、遺伝子治療薬です。adenovirusを用いた研究は歴史があり、遺伝子治療用のadenovirusは、最新世代の改変型adenovirusが使用されています。
使用されるワクチン用のadenovirusは、目的に適した改変adenovirusが使用されるはずですが、前世代adenovirusが使用されているようです。この部分は、十分に把握できていないので、今後の調査を進めたいと思っています。
アデノウイルス・ベクターを使ったワクチンとして代表的なものは、やはり、Astrazeneca社のCOVID-19ワクチンです。2021年中には、日本でも集団摂取が予定されています。Astrazeneca社のワクチンに関する情報は、後半に述べています。
adenovirusのウイルス膜表面に、目的の抗体を作りたいウイルスの膜表面タンパク質を発現さたり、ベクターとして組み込んだ遺伝子に目的のタンパク質を発現させることも可能です。現在、新型コロナウイルスのワクチンとしてAstrazenecaの臨床試験が行われているadenovirus vector vaccineがあります(2020)、mRNAなどの核酸ワクチンと比較して、細胞免疫を惹起するため強いワクチン効果が期待できます。ただし、ワクチン効果以外の服反応も起こるため、免疫獲得として摂取できる回数は少ない数回に限定されます。核酸ワクチンの場合は、副次的な反応が理論上はないため、複数回の免疫が可能です。抗体ができるまで、複数の免疫も可能と考えられます(2020/09/08)。
adenovirus vector vaccine (アデノウイルス・ワクチン)は、核酸ワクチンの原理と比較して、抗原提示に関するT細胞の免疫応答が強まる(細胞免疫)、感染細胞への殺傷効果が高い可能性があることから、よりワクチン効果が高い期待があります source: Adenoviral Vector-Based Vaccines and Gene Therapies: Current Status and Future Prospects, 2018。
上記参照文献は、adenovirusに関わる情報を網羅的によくまとめられおり、初学者には貴重な情報源となります。以下、原文の英語を日本語にまとめるとともに記載分類を再編成しレジメ化しました。以下の(数字)は、原文での参照文献番号を表しています。
- 遺伝子投与(核酸ワクチン)による抗原の産生では、抗体の生成は可能だが、抗原提示に関するT細胞の免疫応答が弱い可能性 (核酸ワクチンの弱点の可能性)
- adenovirusのウイルス膜表面への抗原提示、あるいはAdenorirus自体によるアジュバント効果(可能性)では、抗体の生成とT細胞の免疫応答のどちらも強力に得る可能性が高まる
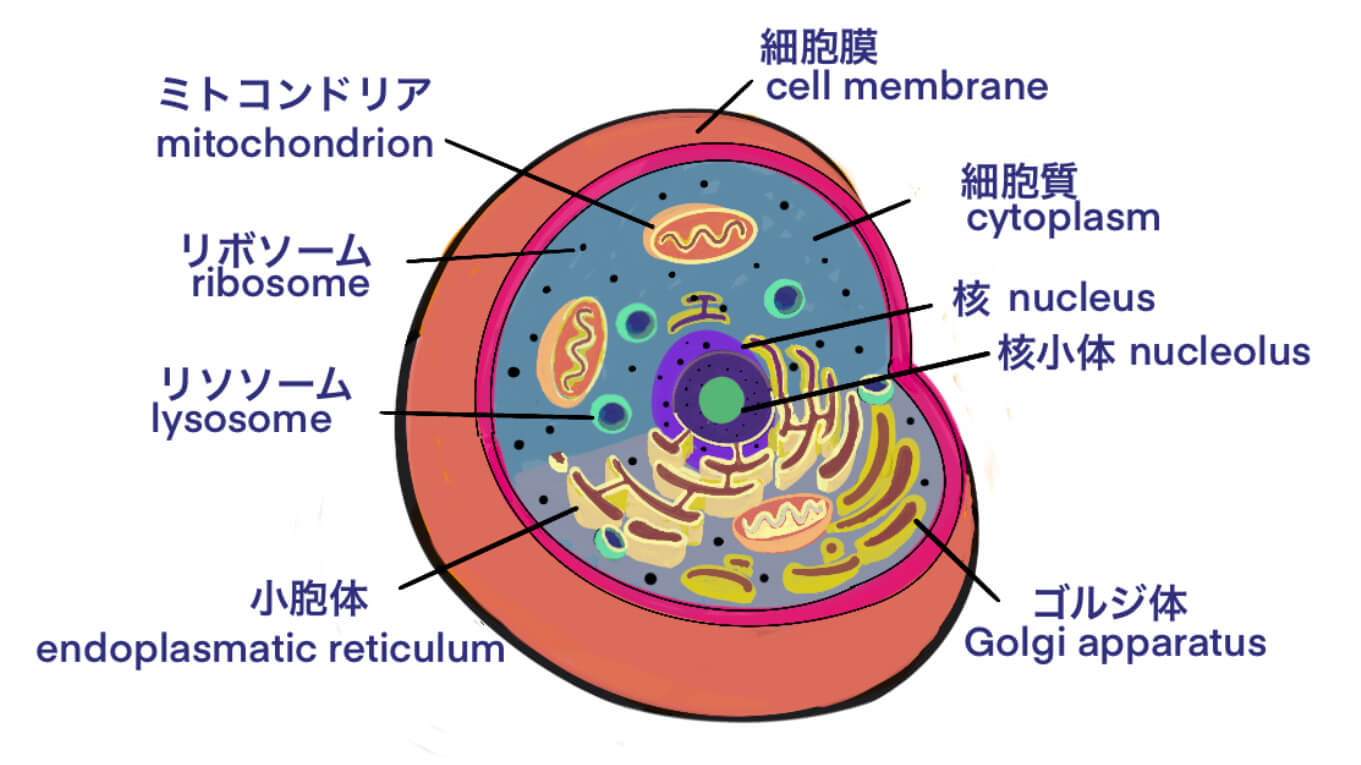
adenovirus
adenovirusの特徴は、DNAウイルスであり以下の通りです。
- カプシドとゲノムで構成されている
- 表面抗原を構成するタンパク質は、(1)ペントン、(2)ヘキソン、(3)ファイバー
- 血清型間で、ヘキソンの超可変領域とファイバーのエピトープ配列の不均一性が高い
- 殆どの人は抗体を持っている
- サイズ : 70 ~ 90 nm
- 26~45kb二本鎖DNAゲノム、両端に100-140bpのフランクを持つ2つの逆方向末端反復を含む
- 相補のDNAはそれぞれタンパク質をコードしている(双方向)
- オルタネイティブ・スプライシングによりmRNAの異なるポリA修飾を使用する
遺伝子導入実験ハンドブック — タカラバイオ —
AAV (Parvoviridae) : ssDNAウイルス, 5kb, 18-26nm, P1レベル, 染色体への積極的なゲノム組み込み(-)
adenovirus (Adenoviridae) : dsDNAウイルス, 36kb, 70-90nm, P2レベル、染色体への積極的なゲノム組み込み(-)
lentivirus (Retroviridae) : ssRNAウイルス, 8-9kb, 80-130nm, P2レベル, 染色体への積極的なゲノム組み込み(+)by Mr. Harikir (2021/02/11)
https://catalog.takara-bio.co.jp/PDFS/transgenesis_experiment.pdf
- 遺伝子は、それぞれ5つの初期遺伝子と後期遺伝子に分けられる
- 初期遺伝子 : E1, E3, E4は、自然免疫を抑制する
- E1
- E1A
- ウイルスDNA合成に必要な遺伝子の転写の活性化
- 宿主細胞への影響 : p53依存的と非依存的によりアポトーシス(ハイジャックアポトーシス)を誘導(9)
- immuning回避(T細胞への抗原提示の減少(67) )、腫瘍形成(60,61)
- E1B
- 宿主タンパク質(p53, Bak, BAX)への結合によりアポトーシスを阻害する(68~79)
- E1A
- E2
- E3 : 免疫調節機能
- 感染細胞を免疫細胞から認識されないようにする (78)
- 検出MHCクラスI分子の表面輸送の遮断
- 宿主細胞の表面にあるNK細胞受容体を減少させる
- Death receptorsのダウンレギュレーションすることにより、adenovirus感染細胞のアポトーシスを阻害する
- 感染細胞を免疫細胞から認識されないようにする (78)
- E4 (74, 75, 76, 77)
- E1B-55とE4のタンパク質は、Daxxタンパク質を誘発することで、抑制されているウイルスのゲノム発現を可能にする
- E1B-55kとE4の結合タンパク質は、自然免疫である抗ウイルス応答を抑制する
- 細胞に取り込まれた時に発現する
- タンパク質合成、ウイルス複製に必要な宿主遺伝子の発現調整
- E1
- 後期遺伝子
- L1-L5
- アセンブリ、放出、宿主細胞の妖怪(1,5,6)
- 初期遺伝子 : E1, E3, E4は、自然免疫を抑制する
- 非エンベロープ
- 20面体DNAウイルス
- 50以上の血清型 (遺伝的に多様)
- Adenoviruses (Adenoviridae) (10,11,12)
- Mastadenovirus
- 動物のアデノウイルス(サル、ウシ、ヒツジ、ブタ、イヌ)
- ヒトのアデノウイルス (Human Adenoviruses; HAd)
- 7つ (A ~ G)
- 血清学的特徴では、67種類、更にサブグループ
- Aviadenovirus
- Siadenovirus
- Atadenovirus
- Ichtadenovirus
- Mastadenovirus
- 宿主組織 : 眼、呼吸器、胃腸の上皮など生命の危機に関わらない感染
- 1953年、Roweらにより組織から分離された(2)
- ヒトと動物の間で無症状の気道感染症を起こす
- 免疫不全の患者では生命に危険がおよぶ場合がある
- 殆どのヒトで中和抗体を有している(3)
- 癌療法に使用される(4)
- 構成タンパク質(6, 7, 8)
- ヘキソン
- 主たる表面タンパク質(270 x 3量体)
- 超可変領域を含む。この領域を利用してワクチン抗原にできる
- ペントン
- 20面体の12の頂点に12 x 5量体
- ファイバーと共に宿主細胞の受容体のリガンドとなる
- ファイバー
- 12の3量体が突出している
- ペントンと共に宿主細胞の受容体のリガンドとなる
- IIIa
- カブシドの内側に位置する
- 頂点領域の裏打ちと内包するウイルスゲノムの組み立てに寄与する
- VI
- 内側と外側のカプシドシェルをリンクする
- VIII
- ヘキソンの裏打ち
- V, VII, IX
- DNAゲノムに関連し、ビリオンのコアを構成
- 末端タンパク質は、2本鎖DNAの末端に結合し、複数のVにより作られたコアとリンクして位置を安定化
- ヘキソン
アデノウイルスに対する免疫
宿主におけるウイルス認識
adenovirus、その部品を認識するもの (27,28,29,30,31.32,33,34,35,36,37,38,39,40,41)
- 細胞内でのバターン認識受容体 (PRR)
- adenovirus由来の5’-triphosphateを持つ2本鎖RNAは、RIG-Iなどのcytosolic PRRに認識される
- DNA, RNAは、TLR3, TLR7, TLR8などのエンドソーム膜(endosomal membrane)にあるintracellular PRRsに認識される(48,52,53,54,55)
- 2本鎖DNAの生体内認識 (34,35,56,57)
- TLR9
- DNA-dependent activator of IRFs (DAI)
- DNA-dependent protein kinase (DNA-PK)
- IFNγ-inducible protein 16 (IFI16)
- DEAD (Asp-Glu-Ala-Asp) box polypeptide 41 (DDX41)
- cyclic guanosine monophosphate-adenosine monophosphate (cGAS)
- 病原体関連分子パターン (PAMP)
- PRRがPAMPを感知する
- ウイルス(病原体)であると認識すると、1型インターフェロンを発現しウイルス抑制、炎症性サイトカイン発現 (23,24,25,26,27)
- receptor : Coxsackie adenovirus receptor (CAR)
- 促進因子 : IL-8, TNF-α
- integrin αvβ5 heparin sulfate proteoglycans
- CD46
- sialic acid
- scavenger receptors (マクロファージ、樹状細胞)(33)
- Toll-like receptors(TLRs)
- RIG-I like receptors(RLRs)
- nucleotide-binding oligomerization domain (NOD-like receptors (NLRs)
- cytosolic DNA sensors
- effector molecules
- CD46, desmoglein-2 (type B Adのmacropinocytosis)(39,40)→ IL-12で誘発されるINF-γの産生を抑制する
- 細胞のβ3インテグリンは、pentonのAgr-Gly-Asn (RGD)モチーフに親和性あり
Vectorとしての良くない免疫応答
- adenovirus粒子のみでは自然免疫の誘導は不十分であり、その原因は、DNA由来として残っている(51)
- 肝臓、脾臓のマクロファージの活性化(42,43)
- MCP-1, RANTES(TLR2依存性)の活性化
- IL-1抗体は、adenovirusによる角膜の炎症反応を低減化する(mouse)(45,46)
- TLR9(E1, E3欠損adenovirusでも感知する→角膜炎症、IL-6,IFNα産生)(49,50)
- plasmacytoid dendritic cells (pDCs)は、TLR9-MyD88依存、myeloid DCs (mDCs)は依存しない(48)
- 細胞免疫
- CD4+ Th1細胞
- CD8+ T細胞
adenovirus vector
adenovirus vectorの特徴
- HAd5は遺伝子送達用ベクターとして開発された
- 非複製性
- 広範囲な組織指向性
- ゲノム解析が進んでいる
- 大きなDNA遺伝子挿入が可能
- 宿主ゲノムに組み込まれない
- 宿主細胞の核にepsomeとしてDNAが残る
- 36kbの遺伝子をパッケージング可能
- 自然免疫(先天性免疫)シグナルを活性化することでワクチンとしての利点がある(21,130)
- 効果的な免疫細胞刺激→適応免疫(獲得免疫)である液性・細胞性の免疫応答
- 細胞内の病原体の解決には、CD8+細胞障害性Tリンパ球(CTL)が重要
- adenovirus vectorで運ばれる抗原は、
- MHCクラスI分子を介してT細胞に提示されるめた、adenovirus vectorは、堅牢なCTL応答を誘導できる
- CTLは、ウイルス感染細胞、細胞内病原体、ガン性細胞を強力に認識し死滅できる
- 抗体産生及び導入遺伝子て特異的T細胞の誘導
- 必要な遺伝子をadenovirusから分離し、HEK細胞に担わせることで、共同してベクターを産生させる
- adenovirusのタンパク質とHCVのタンパク質の相同性が高い
遺伝子治療におけるadenovirus vectorの歴史
繰り返し投与により体液性免疫、細胞性免疫、細胞性細胞毒性、発癌などの課題に直面した(129)
- 1992年、alpha-1 antitrypsin (A1AT)欠損症(124, 125)
- 嚢胞性線維症 (CFTR遺伝子)(126)
- 尿素回路関係(オルニチントランスカルバミラーゼ)(127,128)
ワクチンにおけるadenovirus vectorの歴史
- HIVワクチン 2003年~2006年、Merck(131)
- HAd5 vector-based
第1世代
アデノウイルス・ベクターは、HEK293細胞とともに改変が進められてきた(2021/02/11, by MR.HARIKIRI)。
- First generation
- E1削除
- 初期、後期のウイルスタンパク質は、濃度依存的にMHCクラスIによる抗原提示により細胞死を誘発するが、それをホスト細胞以外では産生できないことにより毒性低減化に繋がる(104,105)
- 削除により非複製アデノウイルスとなる (HEK293(ヒト胚性腎細胞), PER.C6などのE1トランスフェクト細胞を使用する (93)
- HEK293には、E1領域にトランス相補性を入れている(組織形質導入能力)
- 自然相同組換えが起こり複製力のあるadenovirus(RCA)が出現する可能性を持っている(98)
- RCAのリスク低減としてのPER.C6では、独自のプロモーター(PGK)を持つadenovirusのE1領域の発現カセットを使用し相同領域を削除(99,100)
- 4.5kb導入可能となった (92)
- E3削除
- 免疫学的経路の阻害(101)が知られている
- 完全に削除された(102)
- 8kb導入可能となった(103)
第2世代
増殖中の複製能力のあるadenovirus生成の可能性を排除できたが、導入遺伝子の発現が少ないとされる。依然として残る課題は、免疫原性と細胞毒性である。
- Second generation
- E1削除 : 第1世代から継承
- E2削除
- E3削除: 第1世代から継承
- E4削除
- 10.5kb導入可能となった
第3世代
ITRとパッケージングシグナルを除く全てのウイルスシーケンスを削除(114)
- Third generation (114)
- ITRs
- packaging signal
- Helper Dependent or gutless adenoviral vectors(115, 116, 117)
- high capacity adenoviral vectors (HCAds)と呼ぶ
- 2種類のvectorが必要(トランスフェクション)
- Helper virus
- ホスト細胞に組み込んでいたウイルス遺伝子補完遺伝子をHelper virusで提供により、adenovirusタンパク質を合成可能となる→ capsidのアセンブリ→HCAD genomeのパッケージング
- HCAdsのみのパッケージングが可能
- packaging signal flanking loxP siteを含む
- Helper virusのパッケージングシグナルは、loxP siteのCreを介した組換えにより阻害されることで、Helper virusのgenomeがadenovirus粒子に集まるのを防ぐ(機能が十分でない場合、Helper Virus汚染の問題が生じる)
- HCAd genome
- ITRsを含む
- packaging signalを含む
- Helper virus
- HEK293細胞
- constitutivery express Cre recombinase
- Helper virus
- 免疫原性と細胞毒性の低減化(118,120,121,122)
- 課題は、生産方法が複雑、Helper virusの汚染問題(123)
- 36kb導入可能となった
新型コロナウイルス・ワクチン
現在、世界で喫緊の課題である新型コロナウイルス(SARS-CoV-2)に対するワクチン開発は、イギリス(英国)のアストラゼネカ(Astrazeneca)が最も進んでいるようです。
英国のAstrazenecaとOxford大学が共同開発しているSARS-CoV-2の感染症(COVID-19)ワクチンは、アデノウイルスをベクターとして使用するAdenovirus vector vaccineです。
現在、臨床試験は、~10,000人程度を予定されるPhase III試験に入っており、今年中には、20億ドーズの供給が始まると言われています。日本へも1億ドーズを供給する準備があると言っています。Phase I/II試験(約1,000人)の結果、中和抗体の上昇と感染した細胞を破壊するT細胞の誘導が確認されており、結果は良好のようです。1回投与では90%代の効果、2回投与では100%の効果が確認されました。2回投与の場合、日本への1億ドースは、5,000万人分の計算になります。
Phase I/IIの臨床試験の内容は、以下の記事もご参照ください。
編集情報 2020/07/22 Mr.HARIKIRI 2020/07/25 追記 (adenovirusの網羅的情報) 2020/08/03 文言整備 2020/08/08 文言整備 2020/09/08 追記(細胞免疫)
以上