タグ: rAAV-production
-
[Bio-Edu] Surfactant – PF-68, PS80 の添加は常識 – 凝集の抑制 – ID12904 [2021/06/19]
Post Views: 1,178 界面活性剤 タンパク質の凝集抑制には、古くから界面活性剤 (surfact…
投稿者

-
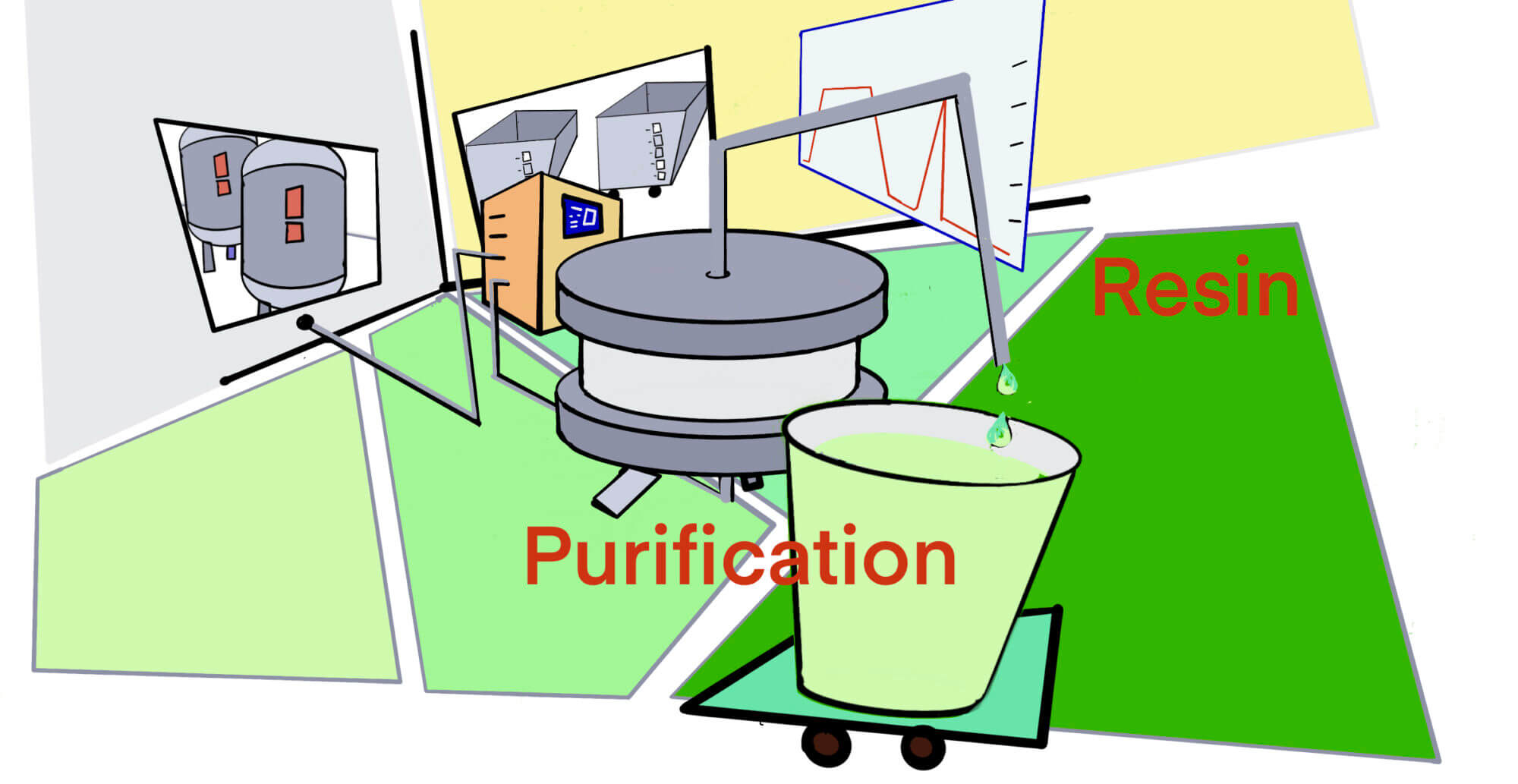
[rAAV] rAAVのUSP/DSP – 製造方法 – emptyとfullの比重, 2015 – SM[2019/10/05]
Post Views: 610 rAAVの製造 2015年時点のrAAV製造(Upstream, Downst…
投稿者

-
[rAAV-Edu] rAAV9の精製方法 – 特許, 2017 – ID2566 [2023/10/23]
Post Views: 481 概要 リコンビナントAAV(rAAV)の大規模精製方法に関する方法特許(Met…
投稿者

-
[rAAV-Edu] rAAV9の精製方法 (ウイルスの一般的な精製方法を理解できる) – 特許,2018 – ID2559 [2023/10/23]
Post Views: 469 rAAV9 vectorの精製方法 培養液のバッファ組成をTFF処理で調整、硫…
投稿者

-
[rAAV] rAAVの精製方法 – 澄明ろ過及び膜による – ID2532 [2019/11/05]
Post Views: 467 rAAVの精製方法 2016年の文献よりAAVの精製について解説する。また、P…
投稿者

-
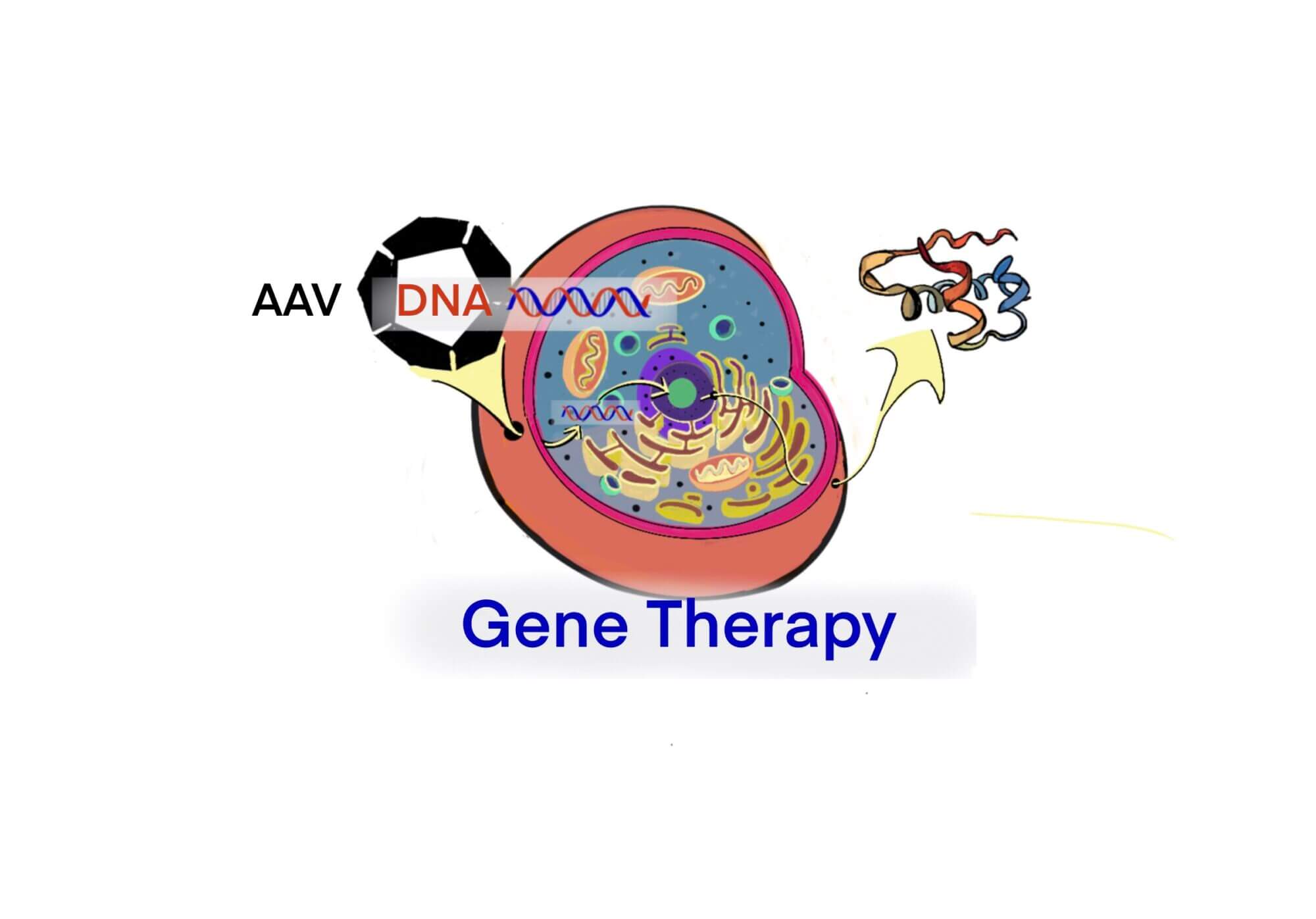
[rAAV] Parvovirusに属するアデノ随伴ウイルス(AAV)をベクター(rAAV)にして遺伝子治療を行う — rAAVの特徴と臨床 (2003) – ID2516 [2019/10/02]
Post Views: 617 AAVベクター Adeno associated virus (AAV) ベク…
投稿者

-
[rAAV] rAAVベクターの特異的精製法:AVB Sepharoseアフィニティ精製(2009年事例) – ID2461 [2019/09/28]
Post Views: 603 1. はじめに(背景・目的) 組換えアデノ随伴ウイルス(rAAV: recom…
投稿者

-
[Bio-Equip] Thermo Fisher 「CaptureSelect」 – AAV1~AAXをキャプチャリングできるAffinity resin – [2019/09/21]
Post Views: 753 ID2320 CaptureSelect CaptureSelectは、複数種…
投稿者

-
[rAAV-DSP] AVB Sepharose High Performance – ID2292 [2019/09/21]
Post Views: 477 AVB Sepharoseの概要 吸着可能なAAVの血清型 Resinの特性 …
投稿者

-
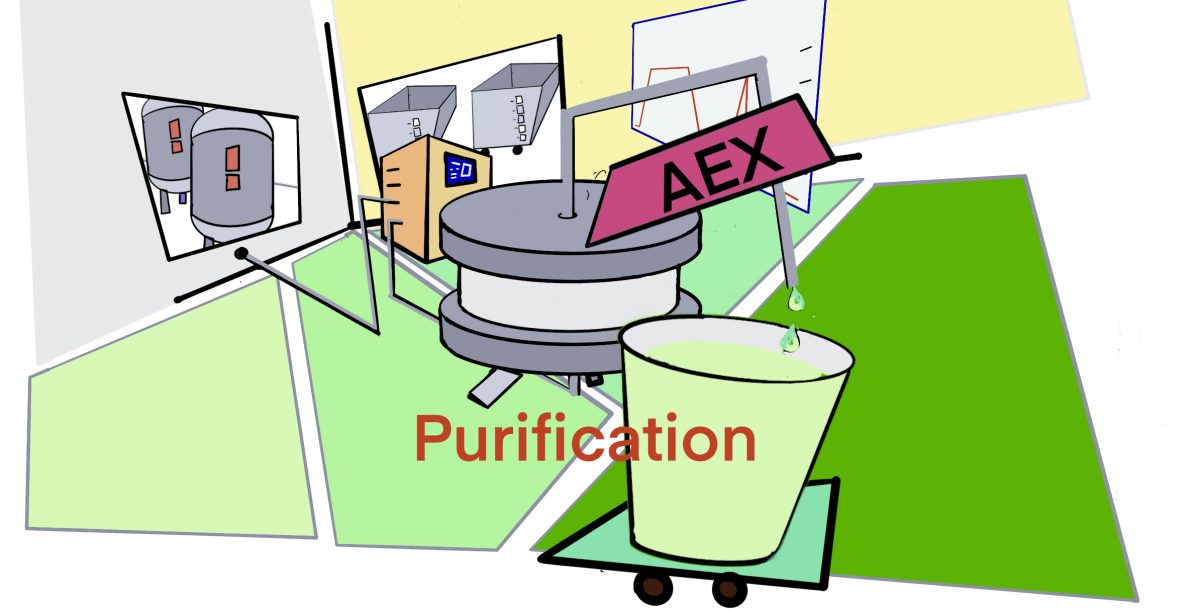
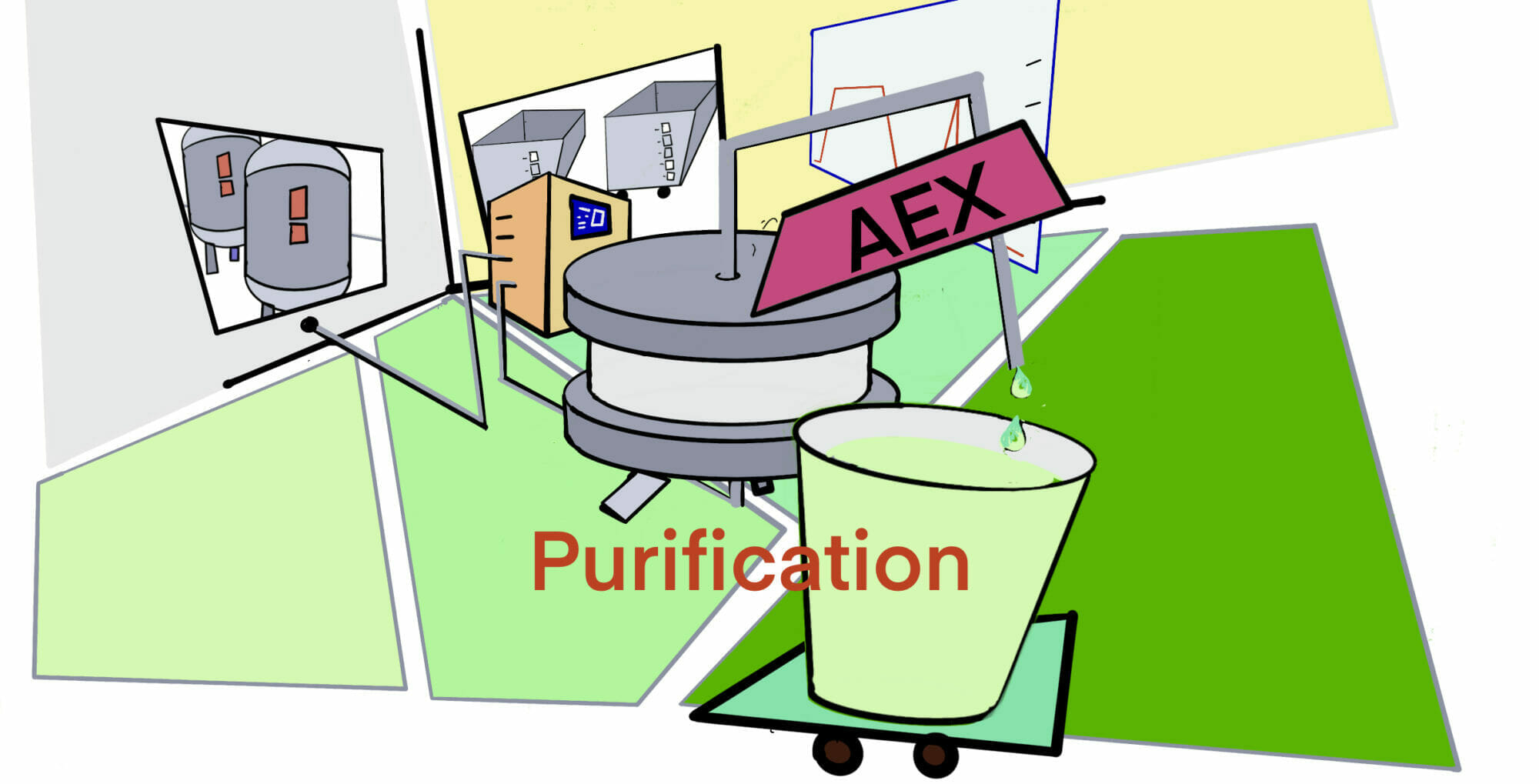
[rAAV-Edu] POROS CaptureSelect (AAV精製 resin) の性能とAEXによるfull/emptyの分離 – ID2271 [2019/09/18]
Post Views: 488 AAVX Resinの特徴 複数の血清型AAVを吸着 POROSは、Therm…
投稿者