ID15607
はじめに
mRNAワクチンの細胞内への伝達としてLNP技術が用いられます。Lipid Nano Particle; LNPの基礎知識を解説します。
因みに、LNPの代わりに病原性のないウイルス (アデノウイルスなど)の外枠(殻;カラ)を使うデザインもあります。AstraZeneca社の新型コロナウイルスに対するワクチンがそれです。
その前に、以下の参考文献の解説では、遺伝子治療薬が何を指しているのか誤解しがちなので、遺伝子治療薬について少し解説しておきます。
現在のmRNAやpDNAを使ったワクチンは、基本的に遺伝子治療薬ではありません。遺伝子治療薬は、半永久的な治療を目的として、1回の投与で治療できるようにデザインされたものです
現在のmRNAやpDNAを用いたワクチンの場合は、その遺伝子が半永久的に体の細胞には取り込まれないデザインとなっているため、遺伝子治療薬には当たらないということです。
また、LNP技術を使用しているのは、(1)物理化学的な安定性が低いという課題の克服と、(2)細胞の外膜(細胞膜)と融合して内容物であるmRNA/pDNAを細胞内に運搬する目的のためです。それでも、mRNAの場合、体内や細胞内に到達できたとしても(1)物理化学的な安定性が低いこと、(2)その宿主の細胞のゲノムに取り込まれることはないこと、により半永久的な治療効果は起こりません。従って、mRNAは半永久的な効果を発揮する伝子治療薬にはなり得ません。
一方、pDNAの場合は、(1)細胞室内に永続的に存在できたり(細胞が分裂するときに、同じように細胞と共に増えることが可能にできる)、(2)細胞のゲノムに対して意図的なデザインによりインテグレーション(挿入)させたり、できるため半永久的に効果を発揮できる遺伝子治療薬になり得ます。
以上の解説のように、現在のmRNA, pDNAを用いるワクチンは遺伝治療薬ではありません(2021/12/05, 追記 by Mr.Harikir)。
参考文献よりLNPを解説
以下の解説は、参考文献の一説です。
低分子干渉RNA(siRNA)、mRNA、またはプラスミドDNAなどの遺伝子治療薬は、病理学的遺伝子のサイレンシング、治療用タンパク質の発現、または遺伝子編集アプリケーションを通じて、ほとんどの疾患を治療する潜在的な遺伝子治療を提供します。 しかし、遺伝薬を臨床で使用するためには、高度なデリバリーシステムが必要です。 脂質ナノ粒子(LNP)システムは現在、遺伝子治療薬の臨床的可能性をより高めるための主要な非ウイルス送達システムです。
2017年に食品医薬品局(FDA)に申請され、トランスサイレチン誘発アミロイドーシス(現在は治療不可能な疾患)を治療するためのLNP siRNA薬が承認されています。
ここでは、まず、全身投与後の肝細胞の標的遺伝子をサイレンシングできるLNP siRNAシステムの開発につながる研究をレビューします。 続いて、LNPテクノロジーをタンパク質置換、ワクチン、および遺伝子編集アプリケーション用のmRNAおよびプラスミドに拡張するために行われた進展が要約されています。
遺伝子治療用のLNPシステムの起源は、低分子の薬剤用としてリポソーム薬物送達システム(リポソームシステム)の開発にあります。リポソームシステムは、二層構造の脂質を含むLNPです。 ホスファチジルコリン(PC)などの多くの膜脂質は、水性媒体に分散すると自発的に二重層構造となります(文献中のFigure 1より)。
- Ethanolに以下を混ぜる
- cationic lipid
- structural lipid
- PEG lipid
- cholesterol
- nucleic acid
- 急速なミキシング
- ミキシングの条件、時間により最適な大きさ、強度、能力のものを作る
ドラッグデリバリーアプリケーションに有用であるリポソームには、いわゆる大きな単層構造(large unilamellar vesicles; LUVs)です。 サイズは100nmの範囲です。現在、世界中の規制当局によって承認されている、静脈内(iv)投与用の9つのリポソームベースの薬剤があります(表2を参照)。
これらのシステムのほとんどは、小分子抗がん剤を含み、iv後の腫瘍部位で優先的に血管外遊出する小さな(<100 nm直径)LNPシステムです。この大きさは腫瘍組織へ浸透(enhanced penetration and retention; EPR)できます。EPR効果は、循環寿命の長いLUVと組み合わせると、腫瘍の送達を10倍以上改善できるとされています。
より詳細は、以下の文献をご覧ください。
Lipid Nanoparticle Systems for Enabling Gene Therapies (2017)
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5498813/
LNPの組成
次に紹介する参考文献では、以下の原材料でLNPを作っています。
- 1,2-distearoyl-sn-glycero-3-phosphorylcholine (DSPC)
- cholesterol
- ionizable cationic lipid (6Z,9Z,28Z,31Z)-heptatriaconta-6,9,28,31-tetraen-19-yl4-(dimethylamino) butanoate (DLin-MC3-DMA)
- (R)-2,3-bis(octadecyloxy)propyl-1-(methoxy polyethylene glycol 2000) carbamate (PEG-DMG)
- (R)-2,3-bis(stearyloxy)propyl-1-(methoxy poly(ethylene glycol)2000 carbamate (PEG-DSG)
siRNAに関する参考文献中で紹介されている文献のレビュー1), 2)では、以下の記載がある。
LNPは一般に直径が約50 nmで、コレステロール(cholesterol)、リン脂質(phospholipids)、ポリエチレングリコール結合脂質 (polyethylene glycol-conjugated lipids)、およびイオン化可能(ionizable)なカチオン性脂質(cationic lipids)で構成されています。
- cholesterol (コレステロール)
- phospholipids (ホスフォリピッド)
- polyethylene glycol (ポリエチレングリコール) – lipids
- ionizable cationic (“イオンになりやすい正荷電体”)lipids
以下の参考文献中の文献レビューでは、LNPの見かけのpKaが約6.4のイオン化可能(ionizable)なアミノ脂質(amino lipids)は、キーコンポーネントであり以下を可能にする、とある。
- 低pH(≤4)でのLNP生成中の効率的なsiRNAカプセル化
- 生理的 (physiological)なpHで循環するLNPの中性表面電荷を確保し、
- ターゲットの細胞内在化後のエンドソーム脱出を促進する
Modular lipid nanoparticle platform technology for siRNA and lipophilic prodrug delivery, 2020, bioRxiv
https://www.biorxiv.org/content/10.1101/2020.01.16.907394v1.full
- Rational design of cationic lipids for siRNA delivery. Nat Biotechnol 28, 172–176 (2010).
- Maximizing the potency of siRNA lipid nanoparticles for hepatic gene silencing in vivo. Angew Chem Int Ed Engl 51, 8529–8533 (2012).
LNPを作る装置
LNPは、以前はリポソームと呼ばれていたもので、脂質二重膜などの構造になっており、目的物を閉じ込めるための器です。
昔は、エバポレータという減圧乾固する装置で、少量調製していましたが、現在では、Precision NanoSystems Incが連続的にNano Perticleにする装置を開発しているようです。スケーラビリティーもあり、臨床試験にも使用可能で、原理的には、コマーシャル製造でも適用可能です。
Precision NanoSystems Incの技術
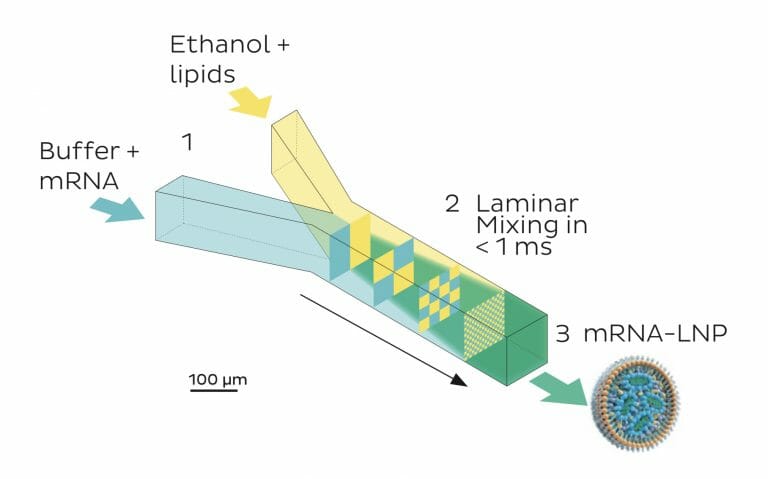
図1.)ナノ粒子を製造するためのマイクロ流体混合技術:溶解した脂質を含む有機溶媒と核酸を含む水溶液
NanoAssemblrカートリッジの2つの注入口チャネルに注入されます。 層流の下では、2つの溶液はすぐには混合されません。
しかし、チャネルに組み込まれた微視的な機能により、2つの流体が混ざり合います。
分子が拡散によって互いに相互作用する、制御された再現可能な方法で。 1ミリ秒以内に2つの流体が完全に混合され、核酸がロードされたナノ粒子の均一な自己組織化をトリガーする溶媒極性の変化を引き起こします。
編集履歴
2020/05/10 はりきり(Mr) 2020/05/27 追記(Precision Nanoparticle Systems紹介) 2021/07/08,追記(文言整備) 2021/12/05,追記(遺伝子治療薬について解説しmRNA/pDNAを用いたワクチンはそれでは無いことを解説)
