ID12872
BioMarin
血友病Aに対する遺伝子治療薬が現実なもにとして世の中に出ます。待ち望まれた患者さんは多くいらっしゃると思います。遺伝子サイズが大きいことから、世界の大手医薬品メーカーすら開発を見送っていた血友病Aです。#バイオテクノロジー.画期的です。素晴らしいです。偉業を達成したのは、ニッチ領域のオーファンドラッグを手掛けている小さなバイオテクノロジー企業、Biomarin Pharmaceuticalです。
P1/2の4年のデータで製造承認申請(BLA)を申請していましたが、2020/08/12のBioMarinの発表ですsource。FDAはBLAを許可しませんでした。追跡データとしてP3終了後の2年間のフォローアップ・データを求めました(~2021/11)。今後、販売開始については更に先になります。
BioMarin Pharmaceutical Incは、1997年に設立されたバイオテクノロジー企業。市場に7つの製品があり、多国籍組織が整備されている。アンメッドニーズを持つ患者に革新的な治療法を提供している。
Financial Report (BioMarin site)
- 2019 : 売り上げ $1700m(1700億円)
編集履歴 ID 12872 2020/04/04 はりきり(Mr) 2020/06/12 追記 (FVIIIについて) 2020/06/20 追記 (販売開始の許可、4年間の臨床データ、競合他社:Roche(中外製薬、Spark)、Pfizer(Sangamo) ) 2020/09/10 追記 (BMN-270の開発概要)
- CIO : Hank Fuchs
- カリフォルニア州ノヴァト
- 社員 3000人
- 2017年に業界最大の遺伝子治療薬製造工場を拡張建設し遺伝子治療用の素晴らしいGMP製造所になっています。
investing.com – より
https://www.investing.com/search/?q=biomarin
血友病A-遺伝子治療薬
BioMarin Pharmaceutical Inc.(ナスダック:BMRN)は2020/02/20、米国食品医薬品局(FDA)が優先審査の生物製剤ライセンス申請(BLA)を承認したことを発表しました。しかし、08/19のBioMarinの発表では、FDAカラの審査完了の通知は受けたものの、更に2年間の追跡データの取得を求められたことで、このライセンスの許可は、2年先の2021/11以降になる見込みとなった。
- 血友病Aの成人向けの調査用AAV5遺伝子治療
(成人で治療効果と予後を見ながら、今後拡大されていくと思われる) - Valoctocogene Roxaparvovec (BMN 270) for Hemophilia A
- 抗体保有率が低いAAV5を選択
- FDAによるこの承認は、米国であらゆるタイプの血友病の遺伝子治療製品として受け入れられた最初のマーケティングアプリケーション
- 3年間のClinical Phase 1/2とPhase 3の中間段階での分析 (2020/06現在の最新)
- その他情報
- FDAによるBreakthrough Therapy指定
- FDA, EMAからのオーファンドラッグ指定
Table 1. Summary of BMN-270 development
| Code No. | BMN-270 |
| Target | Hemophilia A |
| Vector | AAV5 |
| Promoter | |
| GOI | |
| Production Cell | Sf9, source(1) |
| Competitor | (1) SB-525 by Sangamo/Pfizer (2) SPK-8011 by Roche-Spark |
Valoctocogene Roxaparvovec – BioMarin – より
https://www.biomarin.com/products/pipeline/bmn-270/
BMN-270とは
ネットで調査しても、BMN-270がどのような薬剤なのかその詳細がよく掴めていませんが、以下、BMN-270について推測してみます。
血友病Aは、血液凝固因子VIII (FVIII)の機能不全により止血が難しくなっている遺伝子疾患です。日本止血学科から、FVIIIの分子量は300kDaです。下記の参考文献には、プレ体が250kDaです。更に成熟型は、細胞内で200kDa (7kb)になります。この分子量でもAAV(4.9kb)に封入ができません。
そこで、活性型のとしてA1-A2のHeavy ChainとA3-C1-C2のLight Chainを別々にAAVへ封入させる戦略もありますが、シンプルにBドメインを削除した(BDD)をGOIとしている様ですsource(1)。
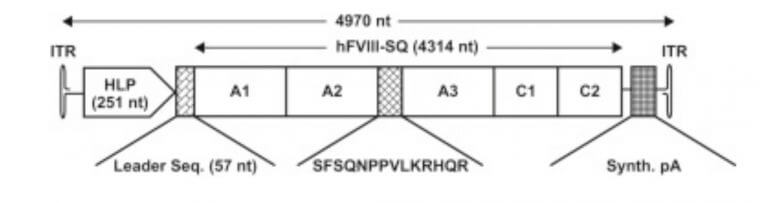
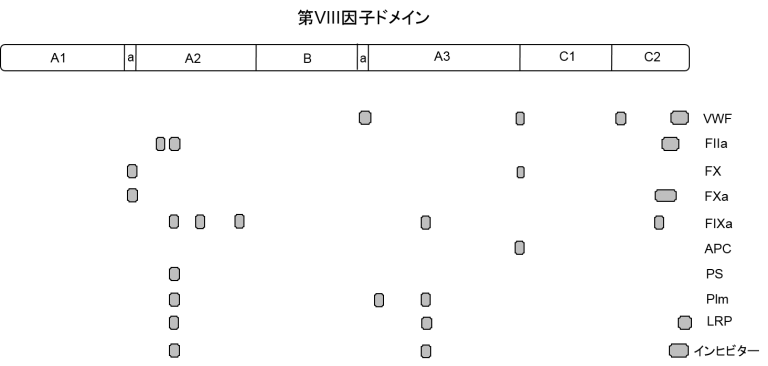
血液凝固因子VIIIのドメイン
日本止血学科
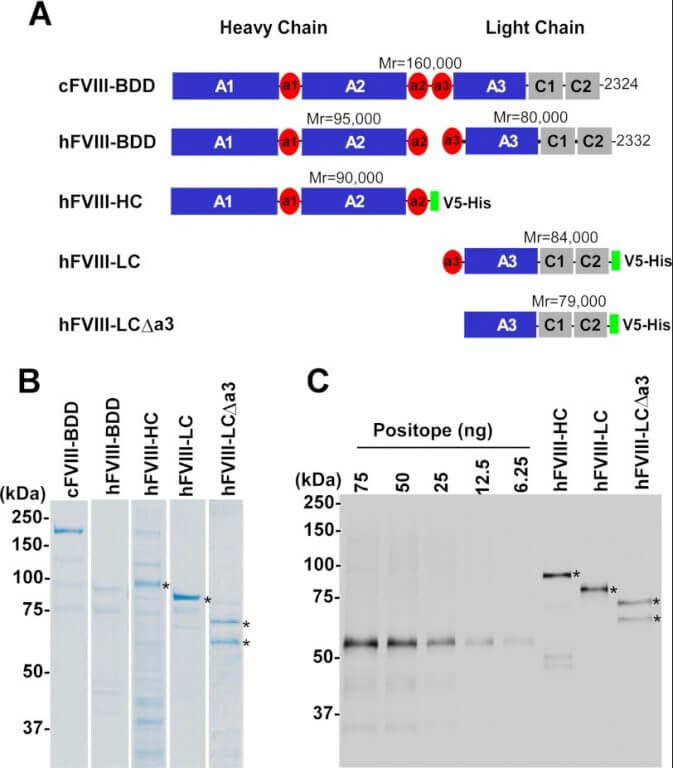
血液凝固因子第VIII因子の構造
Light Chain of Factor VIII Is Sufficient for Accelerating Cleavage of von Willebrand Factor by ADAMTS13 Metalloprotease
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC23069/
参考文献 – AAVは5.2kB以下のゲノムしか封入できないが戦略はある
Expressing Transgenes That Exceed the Packaging Capacity of Adeno-Associated Virus Capsids
Hum Gene Ther Methods. 2016 Feb 1; 27(1): 1–12. Published online 2016 Jan 11. doi: 10.1089/hgtb.2015.140PMCID: PMC4761816PMID: 26757051
Kyle Chamberlain, Jalish Mahmud Riyad, and Thomas Weber*
1990の文献には、FVIIIのA1,A2ドメインをAAVに封入し、A3, C1,C2ドメインを別のAAVに封入する研究があります。
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC23069/
Valoctocogene Roxaparvovecの臨床投与量
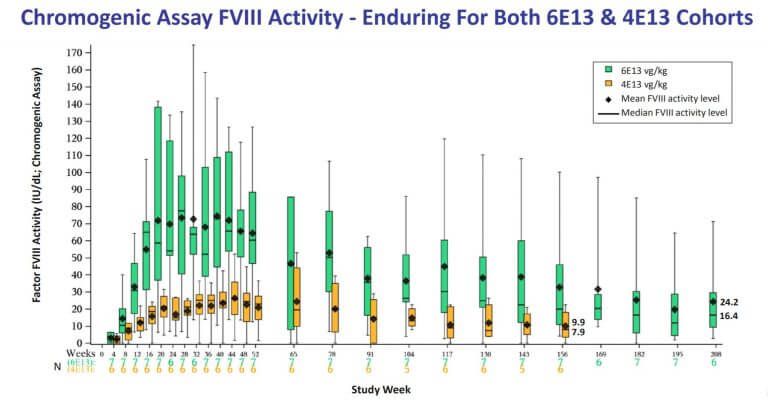
血友病Aの遺伝子治療薬Valoctocogene Roxaparvovec (BMN 270, Valrox)の臨床投与量は、低用量2e12 vg/kg, 高用量4e13 ~ 6e13 vg/kgでした。高容量では、その後の3年間および4年間のコホートで出血制御がうまくいっていると述べています。
Valroxを投与すると12週後からFVIII活性は正常域に上がって来ています(正常域範囲: 50 IU/dL~150 IU/dL)。その後2年間で正常範囲を維持できていますsource(Evauate Vantage)。しかし、その後の臨床観察匂いで、依然としてFVIIIの活性は下がり続けています。
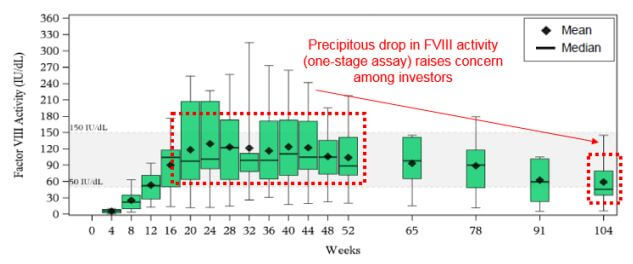
- 現状の治療薬との優位性 : Roche (中外製薬) の抗体医薬 ヘムライブラ (1ヶ月に1回の投与)との差別化?
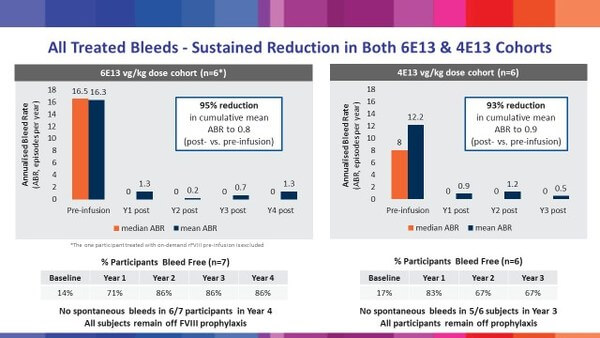
- 治療薬の持続性 : 上図、高用量4年の結果では、FVIIIレベルは正常域を下回っているが、患者の平均出血率は治療前136件/年から1.3~16.3件/年と治療効果は持続(継続臨床観察の実施)
- 治療効果と他社臨床動向により価格が設定される
- BiomarinはFDAとの了解で、FVIII活性を一段階測定方法から発色法(chromogenic assay)に切り替えている
- 競合開発品 :
- Roche (Spark Therapeutics)のSPK-8011, 免疫原性とFVIIIレベルを正常範囲にできないという問題がある(P2/P3)、事前ステロイド投与で免疫原性に対処
- PfizerのパートナーSangamo社のSB-525 (高い用量(3e13 vg/kgで効果、下図参照)source
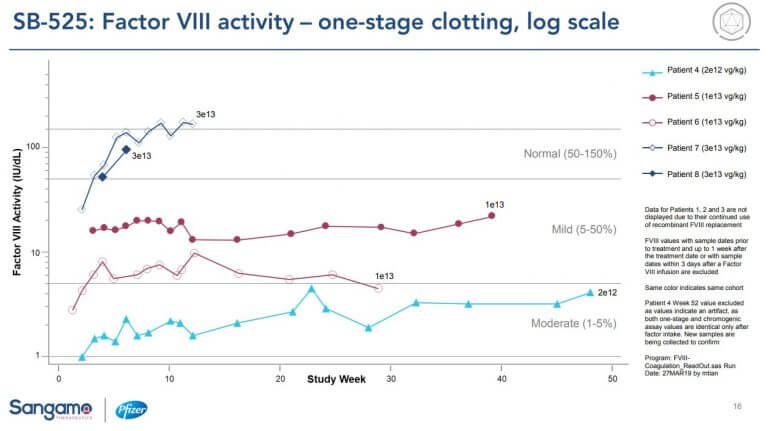
Evaluate Vantage, 2019/05/22
https://www.evaluate.com/vantage/articles/events/company-events/biomarin-hopes-long-term-valrox-data-can-stem-bleeding
製造能力を試算してみる
BIOMARINが持つNovato, California.の製造施設は、年間2,000~3,000人に製剤を届ける事が可能です。
すなわち、3,000人 x 6e13 vg/kg x 70kgが年間の必要量。1000L bioreactor x 2 x 20年間製造数で割ると、1.5E14 vg/Lの培養生産性であることが推定できます。
BioMarin Provides 2 Years of Clinical Data in 6e13 vg/kg Dose from Ongoing Phase 1/2 Study in Valoctocogene Roxaparvovec Gene Therapy for Severe Hemophilia A at World Federation of Hemophilia 2018 World Congress
https://investors.biomarin.com/2018-05-22-BioMarin-Provides-2-Years-of-Clinical-Data-in-6e13-vg-kg-Dose-from-Ongoing-Phase-1-2-Study-in-Valoctocogene-Roxaparvovec-Gene-Therapy-for-Severe-Hemophilia-A-at-World-Federation-of-Hemophilia-2018-World-Congress
BioMarin Provides Highlights of 4 Years of Clinical Data from Ongoing Phase 1/2 Study of Valoctocogene Roxaparvovec Gene Therapy for Severe Hemophilia A
https://www.prnewswire.com/news-releases/biomarin-provides-highlights-of-4-years-of-clinical-data-from-ongoing-phase-12-study-of-valoctocogene-roxaparvovec-gene-therapy-for-severe-hemophilia-a-301068247.html
解説
血友病A
- Hemophilia A
- X染色体に由来、遺伝、1/3のケースで突然変異
- 約10,000人に1人
- 従来、血液凝固因子第8因子 (VIII, 分子量200kDa)の機能不全に対して、血漿分画製剤による補充療法が行われる
- 重症な血友病A患者には、年間100~150回の点滴補充が行われる
- 投薬の評価方法として、年間出血率(Annualized Bleed Rate)がある
その他製品
- ムコ多糖症I(MPS I)のアルデュラザイム(ラロニダーゼ)
- ランバートイートン筋無力症候群(LEMS)のフィルダプス(リン酸アミファンプリジン)
- フェニルケトン尿症(PKU)のKuvan(二塩酸サプロプテリン)
- ムコ多糖症(galsulfacS)のナグラザイム(galsulfase)
- ムコ多糖症IV型A(MPS IV A)のためのVI)とビミジム(エロスルファゼアルファ)。当社は、さまざまな疾患の治療のためのさまざまな製品候補について臨床試験を実施しています。その臨床製品候補には、Brineura、ペグバリアーゼ、
参考文献
BioMarinの現況 (2020)
https://investors.biomarin.com/2020-02-20-BioMarins-Biologics-License-Application-for-Valoctocogene-Roxaparvovec-Accepted-for-Priority-Review-by-FDA-with-Review-Action-Date-of-August-21-2020
ファイザー社、血友病Bの遺伝子治療に関する第Ⅲ相試験を開始, 2018/08/07
SparkからPfizerへ血友病Bの遺伝治療薬開発に関すのライセンス契約に関することも記載あり。
https://www.pfizer.co.jp/pfizer/company/press/2018/2018_08_07.html
uniQure Announces License Agreement with CSL Behring to Commercialize Hemophilia B Gene Therapy, 2020
uniQure社は、血友病Bの遺伝子治療薬をCSL behringに商用化をライセンスに関しての記載
http://www.uniqure.com/PR_EtranaDez_Licensing_FINAL_6_24_20.pdf
Freeline Raises $120M for Pivotal Trial of FLT180a, a Gene Therapy Candidate for Hemophilia B, 2020
Freline社は、血友病Bの遺伝子治療のピボタル試験のために$120Mを獲得した
https://hemophilianewstoday.com/2020/07/10/freeline-raises-120m-to-support-pivotal-trial-of-flt180a-a-gene-therapy-candidate-for-hemophilia-b/
