タグ: E.coli
-
気になる企業 – ファーメランタは組換え大腸菌でオピオイドの商用生産を目指している – コマーシャル製造にはどの程度の生産量が必要かAIに試算してもらった! [2025/05/19]
Post Views: 93 はじめに バイオベンチャー企業であるファーメランタは,組換え大腸菌によりオピオイ…
投稿者

-
[Bio-Culture] 大腸菌; E.coliの増殖率は細胞長の増大に関わる [2021/02/27]
Post Views: 1,056 大腸菌の増殖率 一般的に、大腸菌の増殖率(growth rate)、1時間…
投稿者

-
[Bio-Edu] 組換え大腸菌で造らせたタンパク質のリフォールディングおよび、その後の精製手順 [2020/08/19]
Post Views: 1,266 はじめに 研究段階のタンパク質の取得は、組換え大腸菌(E.coli)から取…
投稿者

-
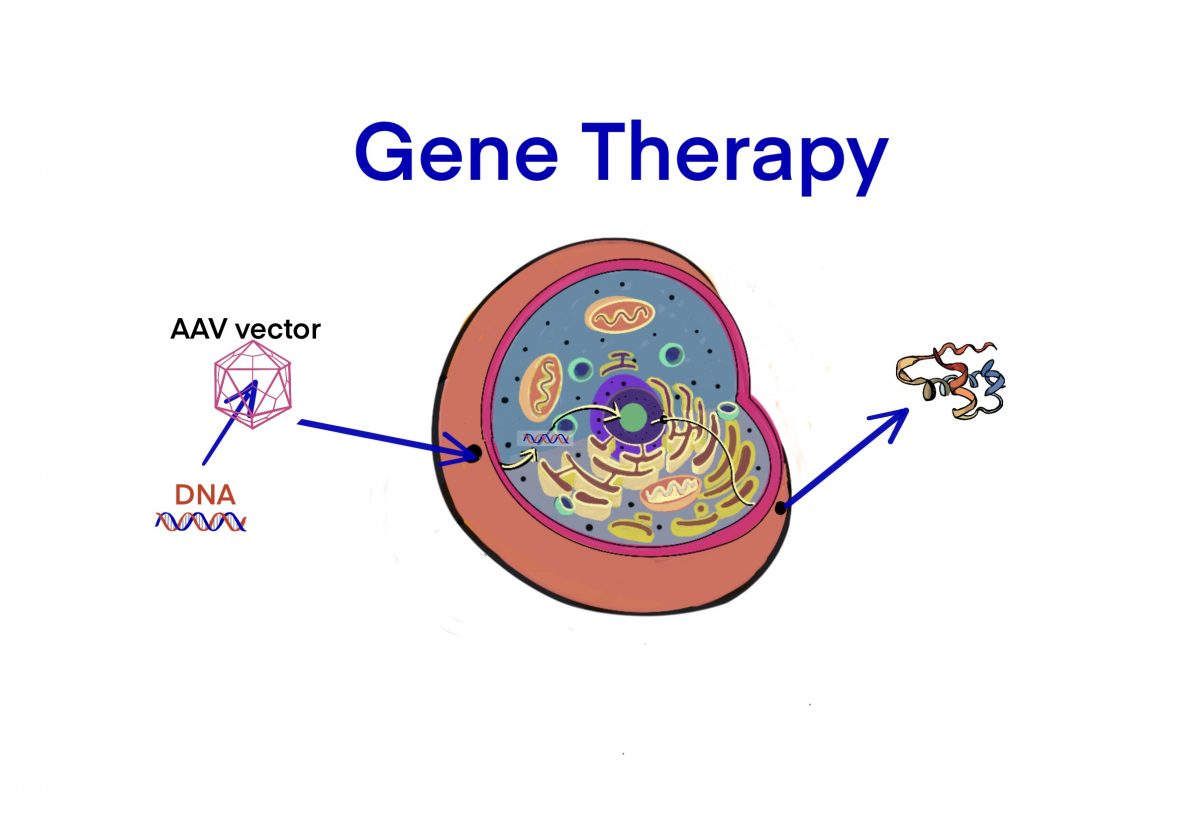
[Bio-Edu] Plasmid – バイオロジクスには欠かせない遺伝子組換え技術、そして rAAVを作るまで! – AAV Vector配列の例 [2020/08/05]
rAAVによる遺伝子治療薬の開発には、遺伝子組換え技術が使われている為、この知識がなくてはならい。 rAAVを…
投稿者

-
[Bio-Edu] 遺伝子組換え大腸菌からタンパク質を精製する製造フロー概略 – ID6624 [2020/01/09]
Post Views: 649 製造方法の概要 大腸菌に目的蛋白質の遺伝子を導入 大腸菌の培養 刺激剤(IPT…
投稿者

-
[Bio-Edu] 今昔 – 天然型から遺伝子組換え型への移行圧力 – ID6626 [2020/01/09]
Post Views: 590 天然原材料のリスク 血漿由来の蛋白製剤は、ヒト由来病原性の混入リスクがあるため…
投稿者

-
[Bio-Edu] 高分子蛋白質の組換え宿主細胞として大腸菌、酵母に勝るCHO細胞 – ID6629
Post Views: 691 大腸菌 大腸菌では、翻訳後修飾における糖鎖付加機能がないものの、糖鎖の付加がさ…
投稿者

-
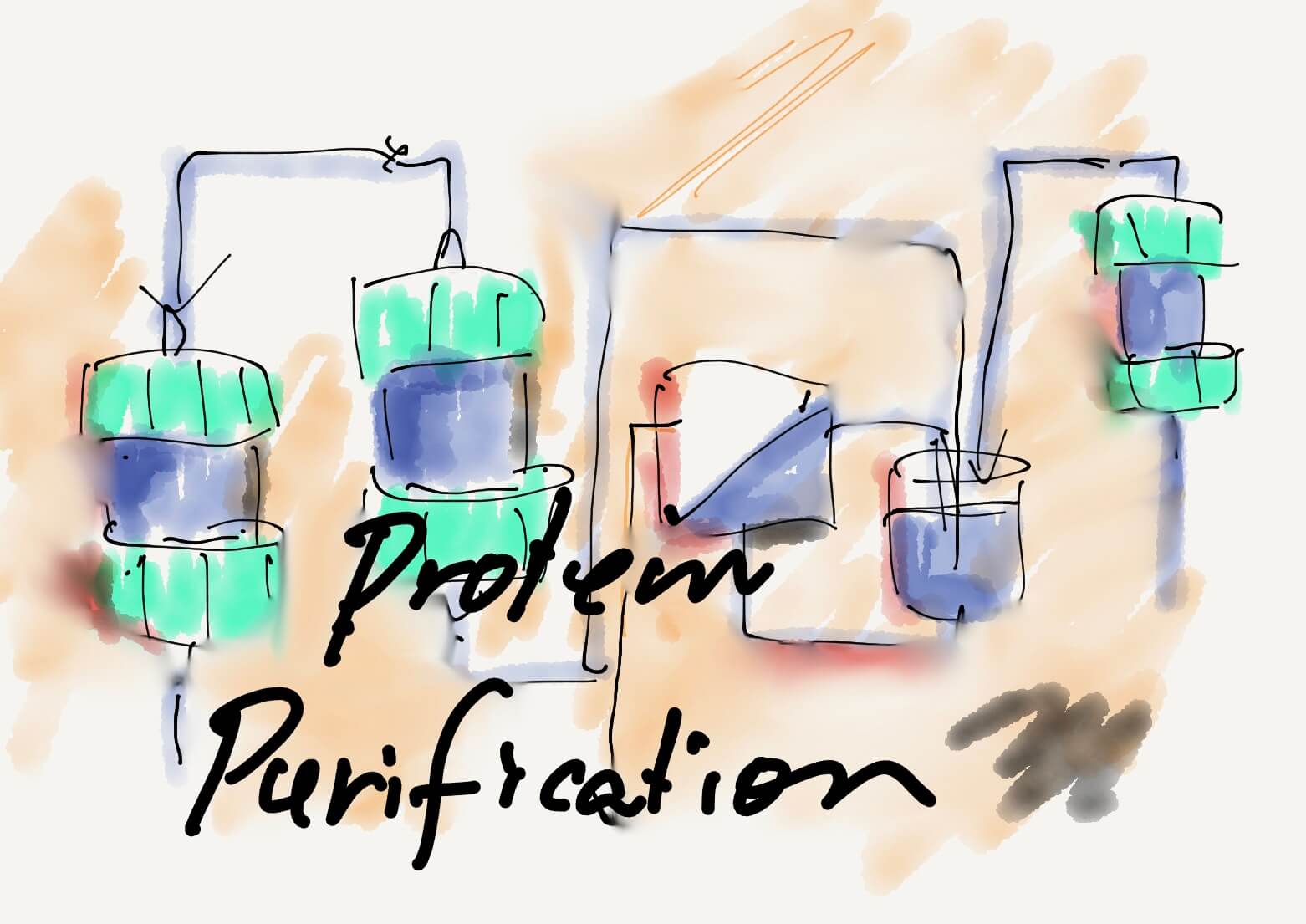
[Bio-Edu] タンパク質(蛋白質)の精製 – 基礎編 – 不純物の定義、RefoldingからUF膜精製、タンパク質精製の定石まで – そしてタンパク質を知る – ID686 △[2021/06/03]
タンパク質精製に関する温故知新、誰でもできるタンパク質の精製概要が理解できる基礎編を解説。最近のrAAV精製を…
投稿者