細胞株の構築
最近のバイオ医薬品の生産細胞株構築フローを以下に示します。
- Host Cell : 目的のタンパク質を発言させるために使用する出発材料である最適化された細胞。目的遺伝子を導入する予定の細胞。
- Transfection : 遺伝子の導入プロセス
- Selection & Cloning : 高い生産性と増殖による世代安定性を維持するモノクローンを選択するプロセス
- Cell Bank : Master Cell Bank (MCB)の候補となる細胞株
- MCB : 品質試験されて正式に決定した生産細胞株(Characterized Cell Bankという言い方もある)
- Working Cell Bank (WCB) : Expanded MCB/マスターセルバンクの拡大培養により細胞を増やして、MCBと土曜用に品質試験されて正式に決定した生産細胞株。ルーチン製造に使用される。
導入遺伝子の構築
- gene配列の合成
- Plasmid DNAの合成
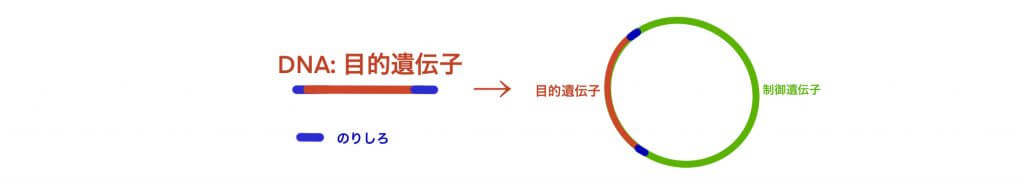
制御遺伝子には、Promoter、Enhancer などがあり、高い生産性を目的とする。抗生物質耐性遺伝子は、目的遺伝子が正しく細胞に導入された場合、それと共に発現するため、抗生物質を添加した培地でも生き延びることが可能となる。遺伝子が導入できなかった細胞は、死滅させることができる。
遺伝子導入とは
遺伝子の導入 (transfection)するの目的は、ある細胞に目的遺伝子を導入(Transfection)することで、宿主細胞の力を借りて、その遺伝子にコードされている蛋白質を生産させることである。
どんな細胞を使うか
一般的に通常の細胞は寄り添います。たとえば、皮膚細胞は、それぞれの細胞は積み上がることなく横に広がる性質があります( monolayer cell ).
バイオ医薬品に使用される細胞は、1個1個の細胞が単独で浮遊するように改良が加えられており、細胞の培養において、個々の細胞に栄養分が均一に行き渡らせることが可能です。コントロールしやすい細胞になっています。
長い歴史の中で、HEK細胞、CHO細胞などが、遺伝子導入する細胞として適しているとして多くのバイオロジクスで使用されています。

原材料
細胞とPlasmid DNAについて
- 1個の細胞を使って1のPlasmid DNAを、その細胞に導入できる技術は、世の中にはありません。
- 細胞もPlasmid DNAも物理化学的に不安定な部類です。人工的な処理やある環境下では、一定の確立で死ぬか壊れてしまいます。
- 実際の導入には、細胞やPlasmidが、死ぬか壊れるかを考慮し、確実に細胞に遺伝子を導入するために、細胞数として数十万個、あるいは数百万個を用意します。
- 細胞の中に導入したいPlasmid DNAも細胞に対して等倍はあり得ず、複数倍を用意します。経験則も存在します。
導入 ( Transfection )
導入法の種類
- リン酸カルシウム
- リン酸カルシウム溶液とPlasmid DNA複合微粒子を細胞に混和すると、プラス荷電化によりマイナス荷電している細胞膜表面に結合し、その後、エンドサイトーシス機構で取り込まれる
- リン酸カルシウム溶液とPlasmid DNA複合微粒子を細胞に混和すると、プラス荷電化によりマイナス荷電している細胞膜表面に結合し、その後、エンドサイトーシス機構で取り込まれる
- 陽イオン性脂質 (lipofection*1)
- Plasmid DNAを包含したリン脂質と細胞膜が膜融合する原理で導入する
- 試薬 ThermoFisher
- マグネットフェクション (magnetofection)
- 作製した磁気ナノパーティクルとPlasmid DNAの結合物を、底に沈めた細胞がある容器に注入し、細胞へ向かうように容器の下から磁気をかけて導入する
- 試薬 funakoshi
- エレクトロポレーション (electroporation)
- エレクトロトランスポレーターを使用して電気のパルスをかけて細胞膜に小さな穴を開けてPlasmid DNAを導入する
- 装置 参考記事*
- ウイルス (virus vector)
- 原理的にはLipofectionと類似。包含体としてのキャリアとしてウイルスを使われる。retrovirusなどが使われる
参考記事
遺伝子増幅
生産量を増加させるには、導入遺伝子の増幅が行われるDHFR(Dihydrofolate reductase)系、GS(Glutamine synthetase)系などがある。
- DHFR
- DHFRの拮抗剤である MTX(methotrexate)の添加
- dhfr 遺伝子が増幅す る現象を利用
- dhfr 欠損 CHOを使用する
- DG44
- DXB11
- 増幅方法 : MTX の濃度を徐々に上げていく
蛋白質科学会アーカイブ, 2, e050 (2009)
http://www.pssj.jp/archives/files/articles/050.pdf
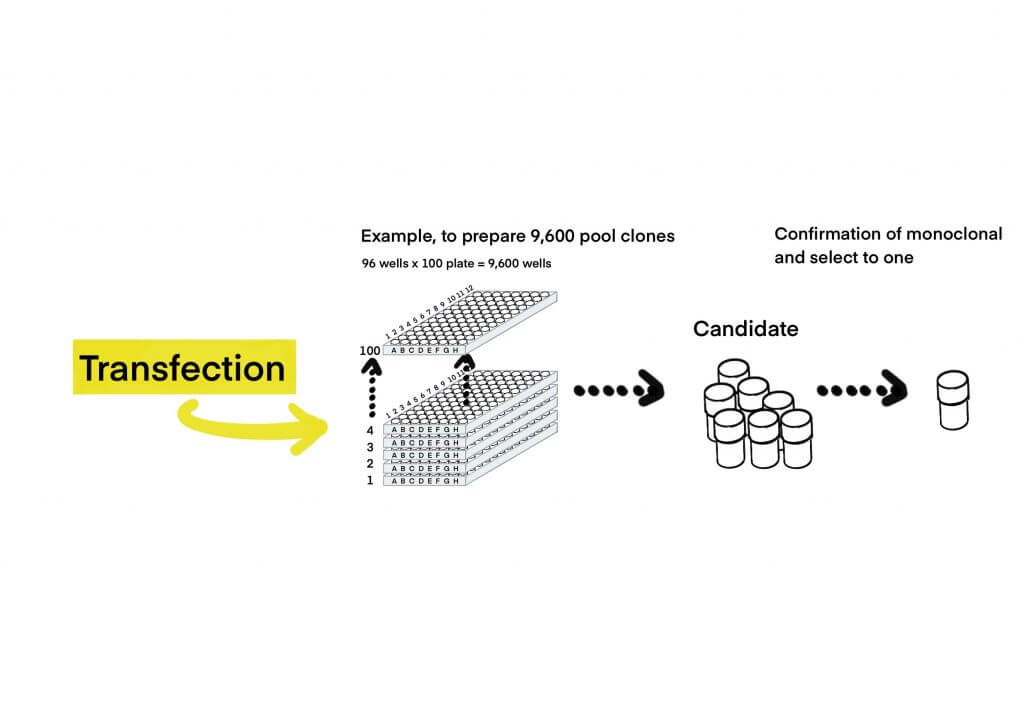
スクリーニングとクローニング
スクリーニングとモノクローニングは、手法によって前後することができる。
スリーニング
スクリーニングの目的
染色体DNAに導入された数十・数百万個の細胞には、以下のような違いが生じます。それを均一な集団にしていく作業がスクリーニングです。
- 導入操作によって死んでいたり、弱っているいる細胞が混在している
- 導入位置よっては、今は死んでいないが、数世代の分裂増殖によって細胞が弱わり死んでしまう細胞が混在している
- 目的遺伝子による目的蛋白質の生産性が低い細胞が混在している
- 元気がよく、目的蛋白質の生産性が高い細胞が非常に低い確立で含まれている
スクリーニングの操作
- まだ、クローンになっていない段階をプール(株)といいます。トランスフェクション後の細胞について、大まかな集団を一塊として、選別を行なっていきます。
- 選別基準
- 高い細胞増殖性 : 組み込んだ遺伝子により、生産される目的物質の生産量が培養当に多くなる
- 高い培養期間生産性 : 一定の培養期間で高い生産性により、生産される目的物質の生産量が培養当に多くなる
- 培養安定性 : スクリーニング過程では、継時的な培養が進められます。その過程では、細胞の世代数が進んで行きます。即ち老化です。すると、死んでいくプールもあり脱落します。元気に生きていくプールが残って行きます
- 高い細胞増殖性 : 組み込んだ遺伝子により、生産される目的物質の生産量が培養当に多くなる
クローニング
クローニグの目的
スクリーニングによって元気が良く、目的蛋白質の生産性が高い細胞について、何種類かを選別できたあと、1つの細胞から増やしてクローン株として取得します。
クローニングの操作
- 先ずは、目的達成のために、処理する母数を増やす
- 最終的には、1個の細胞のみを小さい容器に振り分ける操作の実施(限界希釈法)
- 数十個から数百個の細胞プールとして小さい容器に振り分ける(数千から数万プール)
- 培養装置により増殖させて元気がいい細胞プールを選別する。
- 1と2を何回か繰り返し、細胞プールを数十に絞る
- 限界希釈法により計算上1の細胞になるよう容器に振り分ける
- 元気が良いものを選び、生産性も高い10個程度の方法細胞を選出する
- 最終的には、生産する蛋白質の品質を確認し良い細胞1つに決定する。
- 選んだ細胞がモノクローンであることを確認する。
Cell Bankの調製
限外希釈により、1個の細胞しか、1の培養ウェルに入っていないことを確認して、拡大培養させます。ある程度の細胞数が得られたたら、それをCell Bankとして、クリオバイアルに分注して、液体窒息保管します。
細胞融合法
トラディショナルな技術です。
ELISA用の抗体など、試薬に使用する抗体は、マウス由来の免疫抗体がほとんどです。ずいぶん昔では、このような抗体でもそのままか、抗体のフレームにヒトの配列と差し替えたりしてキメラ化した抗体が、医薬品として使用されていたこともあったようですが、免疫原性の問題を解決すべく、最近の抗体医薬は、完全ヒト化がほとんどです。
細胞融合法による抗体産生細胞株の作成方法の概要は以下の通りです。
- 細胞融合法の手順
- 抗原取得(精製品)→
- 動物に接種(免疫)→
- サクリファイ→
- 抗体産生細胞の取得(脾臓)→
- 不死化細胞と細胞融合(ミエローマ; SP2/0, etc)→
- ハイブリドーマ(hybridoma cell)→
- スクリーニング→
- 増殖性を獲得した抗体産生モノクローナル細胞
- 細胞融合法には。
- 融合効率は、1e-6 ~ 1e-4 (細胞1万個から100万個から1個)
- PEG法
- 電気融合法 (以下に最初の文献リンク)
高効率細胞融合技術の開発
https://www.tosoh.co.jp/technology/assets/2009_02_02.pdf
Human Hybridoma Cells Produced by Electro-Fusin
https://pubmed.ncbi.nlm.nih.gov/6982832/
FEBS Letters, Vol.147, Issue 1, 1982
用語
*1: Lipofection : DNAを封入した脂質二重膜を細胞と接触させて、膜融合の現象により、DNAを細胞内に取りませんるTransfection手法の1つ
- 3.遺伝子導入と発現シリーズ 遺伝子導入と発現(1), Jstage
- 安定型細胞株作成のガイドライン, Lonza
- トランスフェクション手法の紹介・比較, funakoshi
参考文献
徹底網羅!トランスフェクションにおける化学的手法、生物学的手法、物理的手法まとめ
https://www.thermofisher.com/blog/learning-at-the-bench/gene-delivery-technologies/
MATra-Magnet Assisted Transfection / Lipofection - マグネットフェクションとリポフェクションの原理に関する参考文献
https://www.nacalai.co.jp/update/pdf/Information-441-light.pdf
MSD マニュアル プロフェッショナル版 – 医療についての情報サイト
https://www.msdmanuals.com/ja-jp/プロフェッショナル
MSD マニュアル 家庭版 – 医療についての情報サイト
https://www.msdmanuals.com/ja-jp/ホーム
3.遺伝子導入と発現シリーズ 遺伝子導入と発現(1),
https://www.jstage.jst.go.jp/article/manms/7/2/7_2_92/_pdf
安定型細胞株作成のガイドライン
http://www.lonzabio.jp/tech/pdf/tech_12.pdf
トランスフェクション手法の紹介・比較
https://www.funakoshi.co.jp/contents/65100
編集履歴 2020/01/11 はりきり(Mr) 2020/04/23 追記 (Cell Bankの調製) 2020/06/26 追記 (細胞融合法によるHybridoma cell取得) 2020/08/19 追記 (構築フロー)