はじめに
Biologics (生物製剤)では、混入する可能性のあるウイルスについてリダクション能力を評価していることが必要であり、商用製品では、製造工程のウイルス・クリアランス試験が必須である*1。臨床サンプルについてもウイルス・クリアランス試験として、1~2種類のモデル・ウイルスを用いて実施されているのが実情である。
ウイルス・クリアランス試験には、(1) エンベロープを有し比較的耐久性の低いレトロウイルスのモデル・ウイルスとしてX-MLV (MuLV: Xenotropic murine leukemia virus)、(2) エンベロープを持たず小型で耐久性の高いパルボウイルスのモデル・ウイルスとしてMVM (minute virus of mice:MVM = murine minute virus:MMV = Murine parvorirus source)の使用が多い。
- MLV (MuLV; MMLV) source:wiki
- MVM; Murine Minute Virus, MMV; Mice Minute Virus, Murine Parvovirus
編集履歴 2020/05/18 はりきり(Mr) 2020/05/25 追記(ウイルス除去工程) 2020/08/23 充実化(ウイルス除去工程)
製造工程のウィルス・クリアランス試験など、求められる試験 – Eli Lilly and Company, CMC Strategy Forum, Europe, 2018 – より
Modular Retrovirus Clearance in Support of Clinical Development, Bio-product Research & Development
| ウイルス記号 | ゲノム | エンベロープ | サイズ (nm) | 抵抗性 | |
| ネズミ白血病ウイルス | MuLV *2 | single stranded RNA | (+) | 80 – 110 | 低い |
| マウス微小ウイルス | MVM | single stranded DNA | (-) | 18 – 24 | 非常に高い |
MLVのRNAをqPCRで定量
ウイルス・クリアランス試験
一般的なウイルス除去工程
- 培養終了後のハーベスト
- 清澄ろ過膜にAEXモードを持つフィルター機材を採用している場合は、ウイルス除去効果が期待される
- Affinity Chromatography
- 抗体医薬では、Protein Aのアフィニティ・カラムクロマト工程によるウイルス除去効果が期待される
- AEX Chromatography
- 陰イオン交換カラムクロマトの不純物除去工程によるウイルス除去効果が期待される
- CEX Chromatography
- 陽イオン交換カラムクロマトの不純物除去工程によるウイルス除去効果が期待される
- Virus reduction Filtration
- ウイルスの除去を目的としたウイルス除去ろ過工程
- Planova 20NやViresolveが使用される
評価方法
- 除去率(Reduction Level; RL)は、Log10で表記
- 各工程で、ウイルスの添加回収実験の実施
- 各工程でのRLの総和を求めて、製造工程全体のクリアランス能力を算定する
- 細胞アッセイ
- 動物への投与
- PCR
- など
ウイルス除去率の解釈
関連するガイドラインには、ウイルスの除去率に関して考慮すべき要因が示されています1)。以下の要因について考慮することで、プロセスステップをウイルスの不活性化/除去において、以下のように見なすことができるかどうかを決定します
- 有効
- 適度に有効
- 無効
考慮する要因
- 使用したテストウイルスの適切性(セクション4を参照/工事中)
- 検証研究の設計(セクション5を参照/工事中)
- 除去率
- 4 logまたはそれ以上の削減は、モニターウイルスにおいて明確な効果を示していると言える
- 4 logまたはそれ以上の削減は、モニターウイルスにおいて明確な効果を示していると言える
- 不活化の速度論
- 不活化は通常、単純な一次反応ではなく、多くの場合、最初の段階が速く、その後に遅い段階があります。 ただし、時間とともに不活性化率が劇的に低下する場合は、不活性化剤の有効性が失われていること、または残存ウイルス画分が不活性化剤に耐性があることを示唆している可能性がある
- 不活化は通常、単純な一次反応ではなく、多くの場合、最初の段階が速く、その後に遅い段階があります。 ただし、時間とともに不活性化率が劇的に低下する場合は、不活性化剤の有効性が失われていること、または残存ウイルス画分が不活性化剤に耐性があることを示唆している可能性がある
- 不活化/除去の性質
- および特定のクラスのウイルスに対してのみ選択的かどうか。 プロセスステップは、一部のウイルスに対しては非常に効果的ですが、他に対しては効果がありません。たとえば、S / D処理は、脂質を含むが脂質を含まないウイルスに対しては効果的です
- および特定のクラスのウイルスに対してのみ選択的かどうか。 プロセスステップは、一部のウイルスに対しては非常に効果的ですが、他に対しては効果がありません。たとえば、S / D処理は、脂質を含むが脂質を含まないウイルスに対しては効果的です
- プロセスパラメータの小さな変動に対するウイルスの不活性化/除去の影響は、ステップの信頼度に影響する
- アッセイ感度の限界
何回か試験を実施して、異なる除去率が計算された場合、リスクを考慮して評価するなら低い方の値を採用する。
ウイルス・アッセイの例示
ウイルス・アッセイについて、以下の文献から例示として情報を抽出した。ウイルスに応じて感染効率の高い細胞を使用し、用いる細胞の培養に使用する培地についても参考になる。
Cell
- S+L- cell line on semisolid agar colony
- 3T3FL cell for SV assay
- C-182 cell line, a mixture of apparently normal 3T3FL cells and S+L- cells for MuLV assay
media
- McCoy’s 5a medium ( Grand Island Biological Co., Grand Island, N.Y.), 10% FCS and antibiotics
- Eagle’s minimum essential amino acids
- 10% FCS, antibiotics, 20mM thymidine
- (Phenol Redを入れない場合が多い)
Virus (MLV)
- Moloney leukemia virus (MLV) from Electro-Nucleonics Laboratories, Inc., Bethesda, Md., as crude tissue culture fluid from MSV infected JLSV9 cells
- 5 x10E5 FFU/mL to use for the superinfection of S+L- cells.
- MLV from University Laboratories, Highland Park, N.J., as 10% spleen suspension from MLV-infected mice.
- to use for the MSV assays as leukemia helper virus
Virus assays
- A rapid cell culture assay technique for MuLV
- induction of foci in S+L- cells with superinfection
- MSV focus-forming assay
- Both sample are prepared
- by freezing and thawing 3 times cells and supernatant fluids together followed by low-speed centrifugation to remove cell debris.
- stored at -70 C prior to virus assays
追記
ウイルス液の清澄化は、低いGでの遠心上清、超遠心で濃縮する。
レトロウイルス・系統樹
図1(左)の系統樹をもとに、以下詳細にまとめた。
- レンチウイルス属
- EIAV (equine infectious anemia virus), ウマ
- MVV (Mahdi-Visna virus), ヒツジ、ウマ
- FIV (feline immunodeficiency virus), ネコ(免疫不全)
- HIV-1
- SIVAGM
- HIV-2
- スプーマウイルス属
- FFV (feline foamy virus),ネコ,
- HFV
- アルファレトロウイルス属
- ALV (avian leukosis virus),トリ
- ベータレトロウイルス属
- MMTV (Mouse mammary tumor virus), マウス
- JSRV (jaagsiekte sheep retrovirus), ヒツジ,
- MPMV
- ガンマレトロウイルス属
- MLV (murine leukemia virus; マウス白血病ウイルス), マウス
- E-MLV (ecotropic:同種指向性)
- X-MLV (xenotropic:異種指向性)
- FeLV (feline leukemia virus), ネコ
- GALV
- PERV (porcine endogenous retrovirus), ブタ
- MLV (murine leukemia virus; マウス白血病ウイルス), マウス
- デルタウイルス属
- BLV (bovine leukemia virus)、ウシ
- HTLV-1
- HTLV-2
- イプシロンウイルス属
- WDSV
- WEHV-1
- WEHV-2
- SnRV

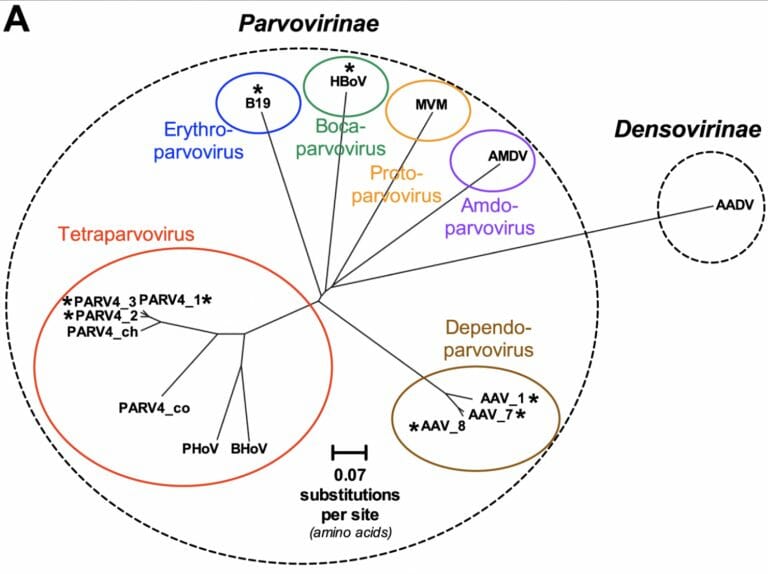
パルボウイルス・系統樹
- Proto-parvovirus
- MVM (minute virus of mice)
- Boca-parvovirus
- HBoV
- Erhthro-parvovirus
- B19
- Amdo-parvovirus
- AMDV
- Tetraparvorirus
- BHoV
- PHoV
- PARV4_co
- PARV4_ch
- PARV4_2
- PARV4_3
- PARV4_1
- Dependo-parvorirus
- AAV_1
- AAV_7
- AAV_8
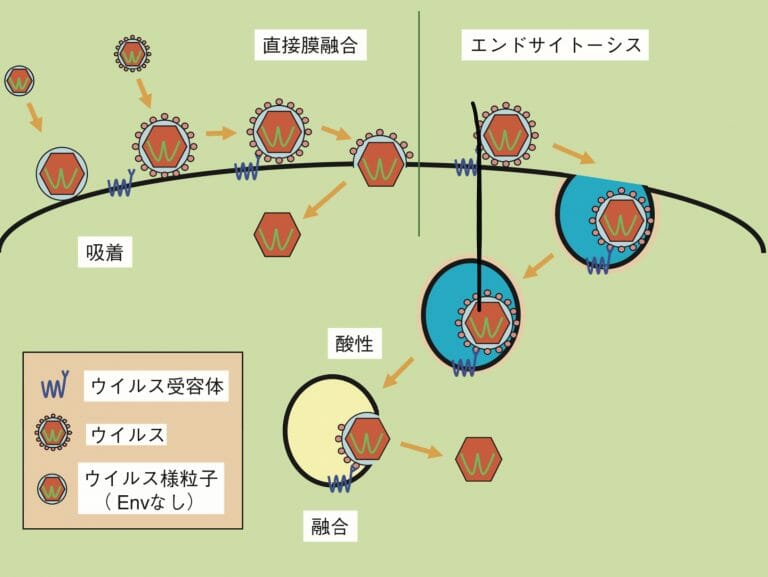
感染様式
レトロウイルスの感染様式
図1(右)は、レトロウイルスの感染様式を示している。
先ず、レトロウイルスは、細胞表面に非特異的に吸着し、その後、以下の機構のいずれかで細胞内に進入する
- 非特異的吸着
- レトロウイルスのエンベロープと細胞表面の受容体が結合
次に細胞質内に以下の機構により侵入する
- 直接膜融合
- エンベロープの構造変化により、エンベロープを除くウイルス様粒子が、細胞質内取り込まれる
- エンドサイトーシス
- エンベロープごと裏返った細胞膜に覆われて、細胞質内に取り込まれる(エンドソソーム)
- 直接膜融合により、エクンドソームから飛び出し、細胞室内に移動する。
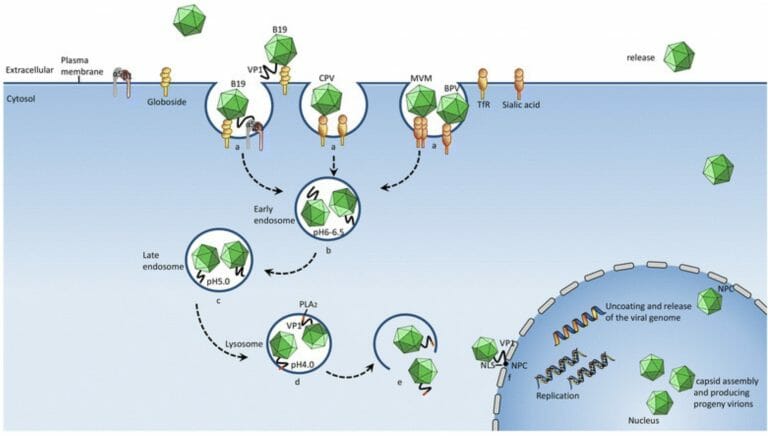
パルボウイルスの感染様式
パルボウイルスは、細胞表面に吸着した後、endocytosisで細胞質内に入ります。その後、endosomeは、内部がpH4になったLysosomeに変換され、同時にphospholipase A2を活性かされて、Lysosomeの膜を破り、ウイルス粒子は細胞質内にでできます。その後、VP1を介して細胞核に入り込まれてゆきます。
1) ガイドライン
以上


