はじめに
培養規模をスケールアップする目的は、コンスト低減化、需要対応などが上げられます。スケールアップした結果、生産性や品質を維持できない場合があります。それは技術移管が失敗したか、そもそもロバストネスな培養条件ではなかった可能性があります。
この記事では、スケールアップする場合の技術移管の考慮点を解説し、パラメータとして生産性や品質にどのように関わっているかも一部示したいと思います。
培養のスケールアップ
バイオロジクスの製造では、商用化に備えてコマーシャル製造に対応した製造所での製造を行うことになります。そうすると、開発サイトからコマーシャルサイトへの技術移管のプロスセか発生します。
大半の場合、その技術移管には、コマーシャルでの需要が増えることを見越してスケールアップが伴うことがほとんどです。
今回、Sartoriusの発表を解説します。プロス開発(15mL培養スケール)から生産規模(2000Lスケール)までの培養スケーラビリティの確保は、Sartoriusが開発したscale-convert toollを使うコトで容易であるとのことです。
基本的な制御パラメータは、以下の投稿をご参照ください。
目的
スケールアップの目的は、実製造スケールまでのスケーラビリティを確認する事です。その後、コマーシャルでのスケールアップもあるかも知れませんが、スケールアウトの手法を取ることもあります。スケールアウトとは、例えば、2,000Lでのスケールアップが確認できているとして、その2,000Lでの実製造をマルチに実施する手法です。
スケールアップの結果、以下のことは、最低限必要な事項です。
- 設計品質 (QbD)の維持
- 品質が変わらないこと
- Key Performance Indicator (KPI)とCritical Process parameter (CPP)に悪影響を与えない
考慮事項
インプット因子
- 製造所の違い (Location) : 培養における外部環境的な影響
- スケールの違い (Scale up) : スケーラビリティに影響
- Bioreactorのデザイン (geometry and design) : スケーラビリティに影響
- 攪拌方法(agitation, impeller type) : 細胞の生育
- ガス供給方法(gassing and sparging) : 細胞の生育
- 温度/pH : グリカン・プロファイル(CQA)に影響
- プロダンション培養において、途中37℃の培養温度をそれより低い温度(37℃/pH7.0→31℃/pH7.0)にシフトさせることで、mAbの生産性を高めることができる。その場合、pH6.8では生産性の改善効果はあまり見られず、pH7.0で著名な改善が見られたref 2)
- 重要品質特性(Critical Quality Attribute; CQA)
温度シフト
組換え大腸菌において、温度シフトして低温にすることは、目的産物の増量が可能であることが知られており、一般的に採用されている。
動物細胞においても、培養の途中で低温にすることで目的産物の増量が見られる。その原理については、多数の文献からある程度の理解が進んでいる3)
- 哺乳類細胞における生理学的温度以下でのmRNA翻訳とタンパク質合成が増加する
- 生理学的温度でない場合、細胞全体的におけるタンパク質合成速度が低下するように考えられるが、コールドショック時に、グローバルなmRNAの翻訳と代謝が減少し、代謝負荷の減少と、mRNAの安定性の増加/分解の減少が相まって、組換えタンパク質のmRNA量が増加する
- まとめると、タンパク質合成自体は減少しますが、翻訳およびタンパク質の折り畳み/分泌機構に関して、組換えmRNAと内因性mRNAとの競合が少なくなる。したがって組換えタンパク質の収量が向上します。
- ただし、哺乳類細胞からの組換えタンパク質収量の潜在的な増加を支えるメカニズムは、以下で説明するように、これよりもはるかに複雑です。
- 開始因子eIF2αのリン酸化を介したmRNA翻訳とタンパク質合成の全体的な減少に加えて、哺乳類細胞のコールドショックはストレス顆粒(SG)と呼ばれる細胞質構造の形成につながると報告されている。
- 最近のデータでは、AMP活性化プロテインキナーゼ(AMPK)の活性化によってタンパク質合成も並行して弱められ、ミトコンドリア機能障害の結果としてmTORシグナル伝達が阻害されることを示唆している。
- さらに、マイクロRNA(miR)の発現は、生理学的温度に移行するとCHO細胞でも調節されるが、これらの小さな非コードRNAは、主にターゲットmRNAの3′-UTRに結合することにより、特定のmRNAターゲットの翻訳の負の調節因子として機能する。 このようなmiRの人工的な操作は、CHO細胞に機能的な効果をもたらす。
- 特に、内因性miR-7の発現は、37°Cで維持された細胞と比較して、培養で経時的に低温にシフトしたCHO細胞で大幅に減少することが示されていますが、miR-7が37°Cで一時的に過剰発現した場合 これにより、細胞増殖が効果的にブロックされたが、miR-7量の阻害は細胞増殖に影響を与えなかった。 しかし、37°CでのmiR-7の過剰発現は、細胞特異的な生産性の増加をもたらす。
- miR-7を過剰発現するCHO細胞のプロテオームに関するその後の研究では、miR-7の過剰発現により93個のタンパク質の発現が減少し、74個のタンパク質の発現が増加することが示された。 翻訳制御、RNAおよびDNAプロセシングに関与するタンパク質は、発現が減少したタンパク質に富んでおり、タンパク質の折り畳みおよび分泌に関与するタンパク質は、上方制御されたカテゴリーに富んでいた。
- グローバルな内因性タンパク質合成は哺乳類細胞の生理学的温度以下で減少するが、特定のタンパク質の合成はアップレギュレートされると報告されている。おそらくこれらはコールドショックに対する細胞応答と生存に必要または不可欠なタンパク質です。
- 伝えられるところによると、2つの哺乳類の低温誘導CSP、Rbm3(RNA結合モチーフタンパク質3)とCIRBP(低温誘導性RNA結合タンパク質)があり、これらは細菌のCSPと配列相同性がありません。生理学的温度以下で哺乳類細胞で発現が変化する20以上の追加の遺伝子とタンパク質を説明する報告がある。
- 低温ショックによって誘発されるタンパク質のアップレギュレーションを定義する際には注意が必要です。タンパク質分解は生理学的温度以下でも低下するため、タンパク質発現の増加ではなく、代謝回転の低下によりタンパク質量が明らかに増加する可能性もあります。
- これら2つの効果(タンパク質合成の増加と存在量の増加)の寄与は、新生ポリペプチド鎖の代謝放射性標識によって研究があり、それによると、新たに合成された材料と総タンパク質溶解物の標準タンパク質分析を決定できることを利用して、37°Cと32°Cで合成されるタンパク質の範囲はほぼ同じであることがわかったが、32°Cでは37°Cと比較して全体的なタンパク質合成が減少するが、発現するポリペプチドは、いくつかある場合を除きます。 増加しているものもある。
温度を低くすることで、以下の具体的な影響が考えられる 3)。
- CHO cell phenotype : Response upon subphysiological temperature culturing
- Cell proliferation : ↓
- Biomass accumulation : ↓
- Cell viability : 延びる
- Apoptosis : ↓
- Culture duration : 延びる
- Metabolism : ↓(lactateなど)
- Tolerance to shear stress : ↑
- Cell-specific and volumetric productivity : ↑ or →
- Protein folding : おそらく改善
- Product quality : 増量可能
アウトプット因子
- 主要プロセス指標(KPI)
- 生細胞濃度(VCC) : mAb生産性
- 細胞生存率 : 不純物含量
- 細胞直径 : (?)
- 製品力価
- グリカン : 品質
手段
スケールダウンモデル(Scale-down Model; SDM)では、以下に示すパラメータが、スケールアップや、その他、Bioreactorの違いなどに応じて変更が生じる可能性がある。
scale-convert toolは、Sartoriusのバイオリアクター製品に応じて、それぞのパラメータを提案する。
- 体積ガス流量(VVM)
- 単位体積あたりの電力(P/V)
- 物質移動係数(KLA)
- ガス転送速度
- 攪拌速度
Bioreactorのスケールアップ
Sartoriusのバイオリアクター製品は、スケールアップを容易にするためにH/D比を合わせている。
- Bioreactorの高さ vs 直径 (H/D)の類似性は、パラメータを類似させる
- 攪拌における電力入力 (W/m3)
ambrを使用したスケールアップ・パラメータの設定
ambr15は、sartoriusのミニチュア・バイオリアクターです。スケールアップでの実験計画法 (Design of Experiments; DoE)による検討によく使われています。
- 15mLのミニチュアバイオリアクターであるため、複数の検討を同時に実施することが可能であり、DoEの実施に向いている
- DO、pHの測定、その他のKPIの測定(サードパーティ製の統合化可能モジュールで自動測定)も自動で測定可能
- ambrソフトウェア
- データの自動集積
- SIMC多変量解析(MVDA)
- 重要プロセスパラメータ(CPP)の特定
- 最適化範囲とロバストネスな範囲の特定
検討内容
15mLから2,000Lのバイオリアクターにおいて、Sartoriusが開発したscale-convert toolが、培養スケールの違いがあっても、同等な培養が可能で同等な品質のmAbを得られるかの検証内容。
- 細胞株
- ヒトIgG1 mAb (Cellca CHO DG44 (Sartorius)
- 工業的に使用(イギリス、アメリカ)されているホストセル
- ambr15と250mLから2,000L SUBへのスケーリング
- KPIとCQAへの影響を確認
- 攪拌の最適化
- スケール変換ツール(by Sartorius)使用により15mLから2000LのSUBでの双方向なスケーラビリティを確保するアルゴリズム
- 剪断力の最小化
- 均一な細胞の混合
- 電力入力(P/V)
- 攪拌翼の速度
- レイノルズ数(Re) : 攪拌速度を必要とする
- スケーラブルなガス処理戦略
- kLa : DECHEMAガイドライン1)に従い、ambr/UniVesselおよびBiostat STR Bioreactorにおいて決定されている
- 特定のDO設定でのガス調整で81 L/hのスケーラブルなkLaの算定
- スモールスケール・バイオリアクター
- ambr15 (15mL) : 2L~7Lのベンチトップ・スケールを模倣
- ambr250 (250mL) : スケールアップ開発に適する(H/D比)
- 1000Lを模倣可能な結果が得られた
- ベンチトップ・バイオリアクター
- UniVessel (5L)ガラス・バイオリアクター(Sartorius)
- 商業規模バイオリアタクー
- BIOSTAT STR SUB (50L, 200Lおよび2,000L)
- H/D比は同一 : 2/1
- インペラーとbag直径の比は同一 : 0.38
- bag : FlexSafe STR bag
- Sartocheck 4 Plus : バッグのリークテスト
- スケーラビリティ研究デザイン
- ambr15, ambr250, BIOSTAT STR 50L, 200L, 2,000L
- 履歴データソース : Sartoriusの米国データ、インドのデータ、米国のデータ
- 検討項目 : スケール全体で比較
- パフォーマンス
- KPI
- mAb力価
- CQA
- 条件抽出
- 播種前の条件
- 生産用培地の温度平衡(~36.8℃/4時間)と供給時間(1日)
- プロダクション段階
- 播種直前
- BioPAT ViaMassセンターのゼロ調整
- 攪拌とガス処理関連パラメータkLa = 81/hを満たすパラメータ設定
- 播種直前
- 播種前の条件
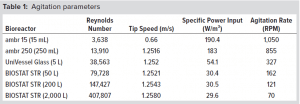
- 続き(スケーラビリティ研究デザイン)
- 続き(条件抽出)
- 温度: 36.8℃
- pH7.1
- DO 60%
- Re (>3,000)
- Impeller 先端速度 : 0.6~1.25 m/s
- 30~200 W/m3
- 注(上記の表の説明)
- 先端速度(Tip Speed)とReynolds Numberは、ambrの場合 < BIOSTAT STRの場合となります。そり理由は以下の通り
- ambrのImpeller数は1枚
- BIOSTAT STRのImpeller数は2枚はと比較して、低くなる
- 先端速度(Tip Speed)とReynolds Numberは、ambrの場合 < BIOSTAT STRの場合となります。そり理由は以下の通り
- 培養は、Feedを使用した流加培養
- 播種濃度 : 0.2e6 cells/mL (Seed stage), 0.3e6 cells/mL (Production Stage)
- 種培養期間 : 3~4日間 (2.5e6 cells/mL)
- プロダクション培養(9日間、流加培養)
- Feed A
- Feed B
- 400 g/L Glucose to keep 3g/L for production
- ambr15のFeedの方法 : workstation’s automated liquid-handling system
- ambr25のFeedの方法 : syringe pumps built into the ambr workstation
- 5Lベンチトップ/BIOSTAT STRのFeedの方法 : peristaltic pump
- サンプリングと分析
- 自動採取
- ambr15/FlexSafe STRバッグ
- 付属の光学シングルユースDO/pHセンサー
- グルコース/乳酸 : BioProfile FLEX2自動細胞培養分析システム(Nova Biomedical)
- 浸透圧 : Osmomat 030(Gonotec) or Cedex HiResアナライザー
- ambr250
- 光学式シングルユースDOセンサー、電気化学pHプローブ
- グルコース/乳酸/浸透圧 : BioProfile FLEX2自動細胞培養分析システム(Nova Biomedical)
- BIOSTAT/UniVesselバイオリアクタ
- UniVesselバイオリアクターの電気化学センサー
- グルコース/乳酸 : Radiometer ABL800基本システム(Radiometer,ドイツ)
- VCC/細胞生存率/浸透圧 : BioPAT ViaMass or Cedex HiResアナライザー(Roche Diagnostics、ドイツ)
- mAb生産性
- 培養上清でmAb測定
- N型グリカン・プロファイル分析(スコットランドのザルトリウすにある分析センター)
- 最終的mAb力価は、12日目のサンプル(スコットランドのザルトリウすにある分析センター)
- 補足分析 : LabChip GXII Touchタンパク質特性評価システム(Peerkin Elmer, Seer Green, UK)
- 続き(条件抽出)
- Reference standard
- 30のデータセット(Commercial IgG achieved)
- ambr250のデータセット
- UniVessel
- BIOSTAT STR
- VCCs : >20e6 cells/mL, 80 cell viability at the day of harvest
- 30のデータセット(Commercial IgG achieved)
検討結果
結論
ザルトリウスが開発したスケール変換ツール(scale-conversion tool)を使えば、ambr15から2,000L BIOSTAT STRバイオリアクターまでのスケールアップについて、単一の戦略を適応可能である。
結果

まとめ
Sartoriusのバイオリアクター製品で統一することで、2,000Lまでのスケールアップは、scale-convert toolにより容易に実現可能であることがわかった。
編集履歴 2020/06/20 はりきり(Mr) 2020/09/26 追記 (目的の内容を補充)
0)
A Rapid, Low-Risk Approach Process Transfer of Biologics from Development to Manufacturing Scale
BioPreocess Internatioanl, 2020/03/24
https://bioprocessintl.com/sponsored-content/biostat-str-bioreactors-a-rapid-low-risk-approach-process-transfer-of-biologics-from-development-to-manufacturing-scale/
1)
DECHEMA Guidline
https://dechema.de/dechema_media/Downloads/Positionspapiere/SingleUse_ProcessEngineeringCaracterisation_2016.pdf
2)
プロダクション培養の温度を途中37℃から低い温度でシフトすることで、mAbの生産性が高まる。
pH Condition in temperature shift cultivation enhances cell longevity and specific hMab productivity in CHO culture (2006)
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3449411/
3)
CHO細胞の培養条件として、温度のインパクトなどの文献レビュー。27~35℃は、mild subphysiological temperatureと表現されている。
[Review] The impact of process temperature on mammalian cell lines and the implications for the production of recombinant proteins in CHO Cells (2014)
https://www.openaccessjournals.com/articles/the-impact-of-process-temperature-on-mammalian-cell-lines.pdf
4)
CHO細胞における、pCO2、pHの培養バラメータは経験的に生産性を高めることが知られているとし、CHO細胞の代謝とエネルギーの代謝に関わっていると言っています。
The Less the Better: How Suppressed Base Addition Boosts Production of Monoclonal Antibodies With Chinese Hamster Ovary Cells (2019)
https://www.frontiersin.org/articles/10.3389/fbioe.2019.00076/full
