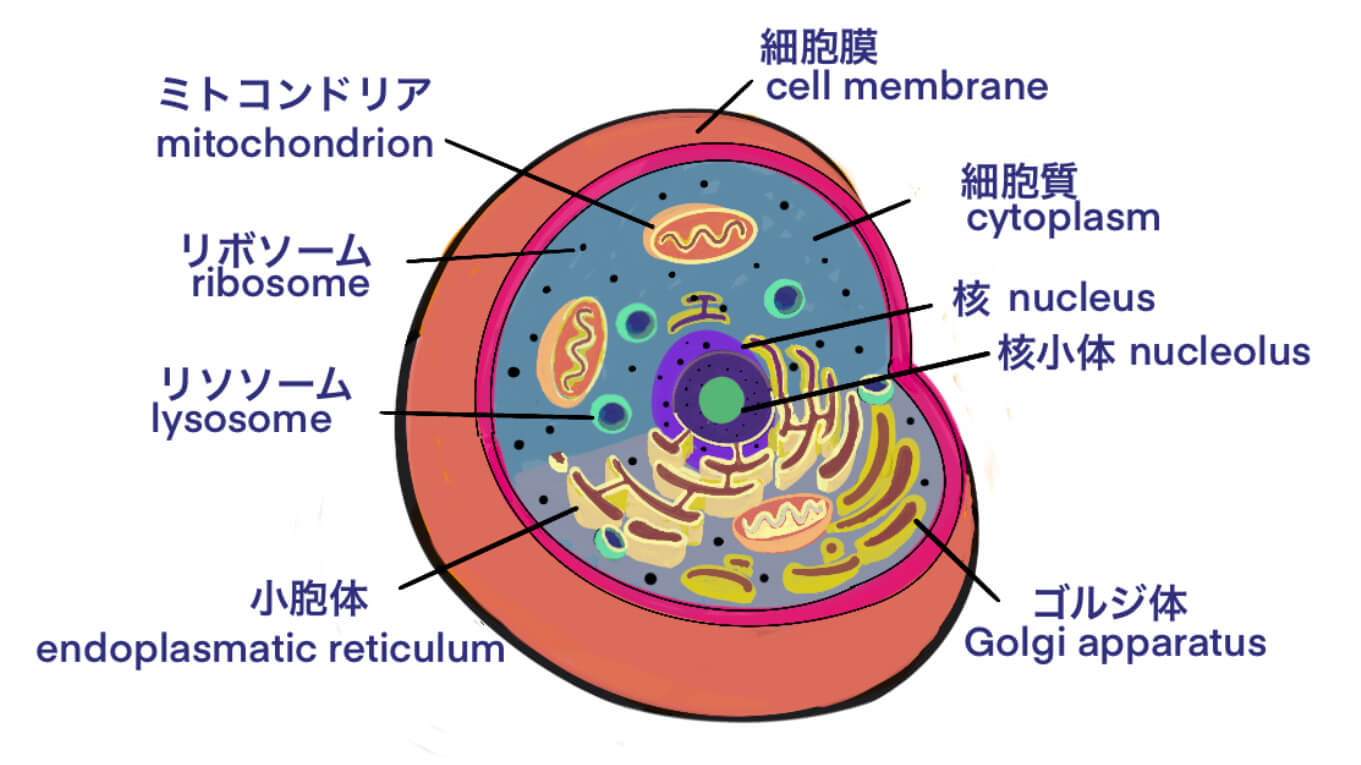
タグ: mRNA
messenger RNAのこと
-
[Vc] 各社が開発したCOVID-19ワクチン情報リンク – [2021/10/08]
BioNTech社とPfizerが共同開発するmRNAをベースの新型コロナウイルス感染症に対するワクチンです。…
投稿者

-
気になる企業 – Sanofi – 新型コロナワウイルス・ワクチンの開発を組換えタンパク質ベースとmRNAで臨床試験が進められている [2021/03/12]
Post Views: 914 Sanofi France (54, rue La Boétie 7…
投稿者

-
[Vc] Moderna – COVID-19 ワクチン臨床(Phase 3の中間結果は94.5%の有効性を示した – ID19527 [2020/11/16]
Moderna社は、新型コロナウイルスのmRNAワクチンを開発している。臨床は、Phase 3を進めており、中…
投稿者

-
[Vc] Pfizerの新型コロナウイルスに対するmRNAワクチン – Pfizer-BioNTech COVID-19 Vaccine の組成 [2021/06/10]
BioNTech社とPfizerが共同開発するmRNAをベースの新型コロナウイルス感染症に対するワクチンです。…
投稿者

-
気になる企業 – Precision NanoSystems Incは、mRNA-LNPを作る装置 “NanoAssemblr” を擁してCOVID-19に挑む [2020/05/28]
Post Views: 1,240 Precision NanoSystems Inc Precision N…
投稿者

-
[Data Link] mRNAワクチンの情報収集 – ID15773 [2020/05/16]
Post Views: 860 mRNA製品に関連情報収集 バイオロジクス関連のデータリンクとしてここに格納し…
投稿者

-
[Vc] mRNAワクチンの製造方法、moderna社とBiaseparations、その他から概略を学ぶ – ID15769 [2021/05/10]
moderna社のデモ・ビデオから、mRNAの開発初期の製造法、及RNAを製造委託する場合の受託会社とその製造…
投稿者

-
気になる企業 – Arcturus Therapeutics – mRNAによる希少疾患とワクチン開発に特化 – ID15742 [2020/05/16]
Post Views: 875 Arcturus Therapeutics 2013年に設立、カリフォルニア州…
投稿者

-
[Vc] mRNAワクチンとは – Sanofi, Modernaなどが開発を進めている – ID15091 [2020/05/23]
mRNAを用いた医薬品は、新型コロナウイルスに対するワクチンとして、開発完了が近々見込まれている。mRNAワク…
投稿者