タグ: education
-
[rAAV-Edu] AAVベクターに関する「生物多様性影響評価書」の作成 – [2019/09/15]
Post Views: 419 ID2177 生物多様性影響評価書 rAAVなどを用いた遺伝子治療による治験を…
投稿者

-
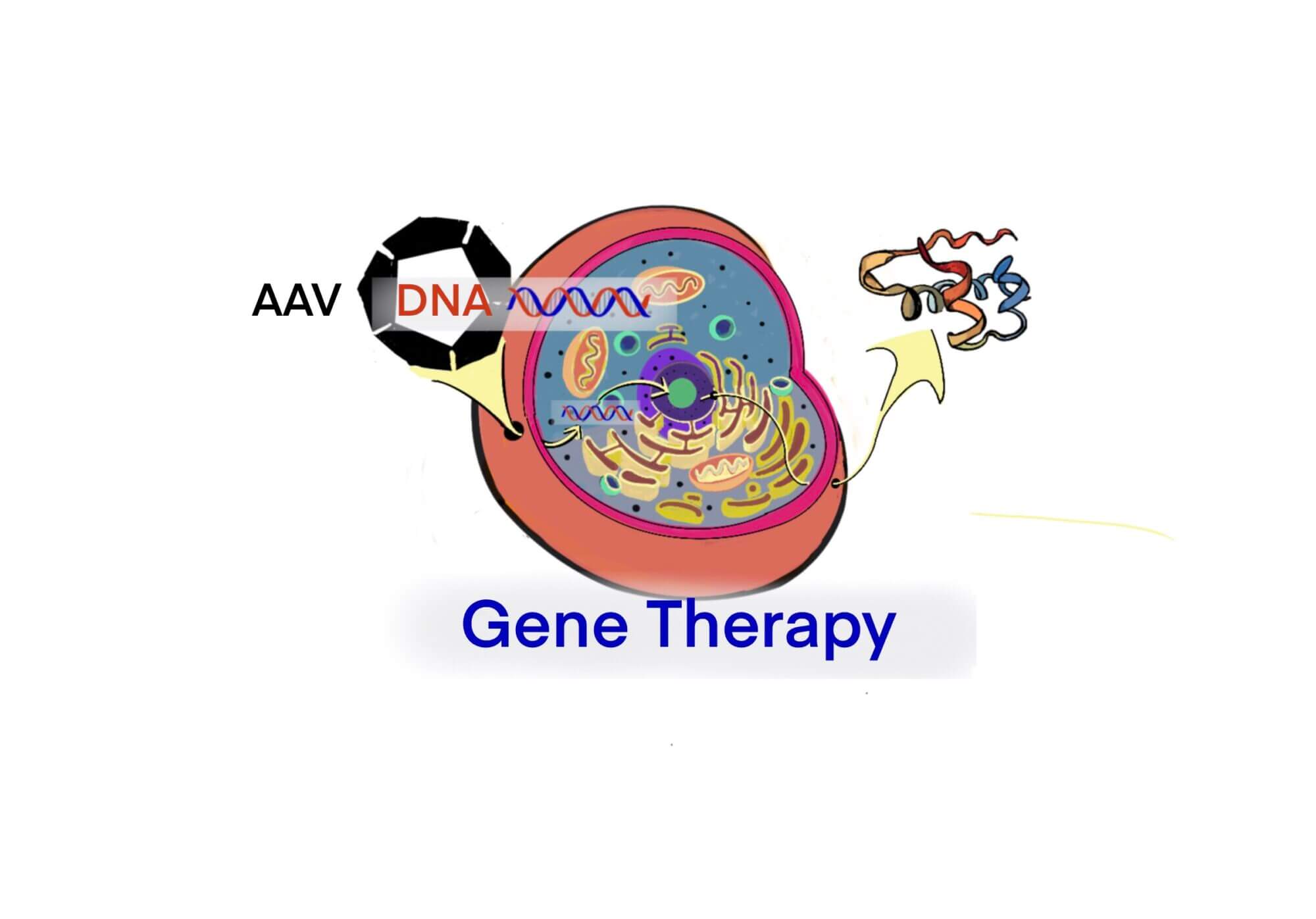
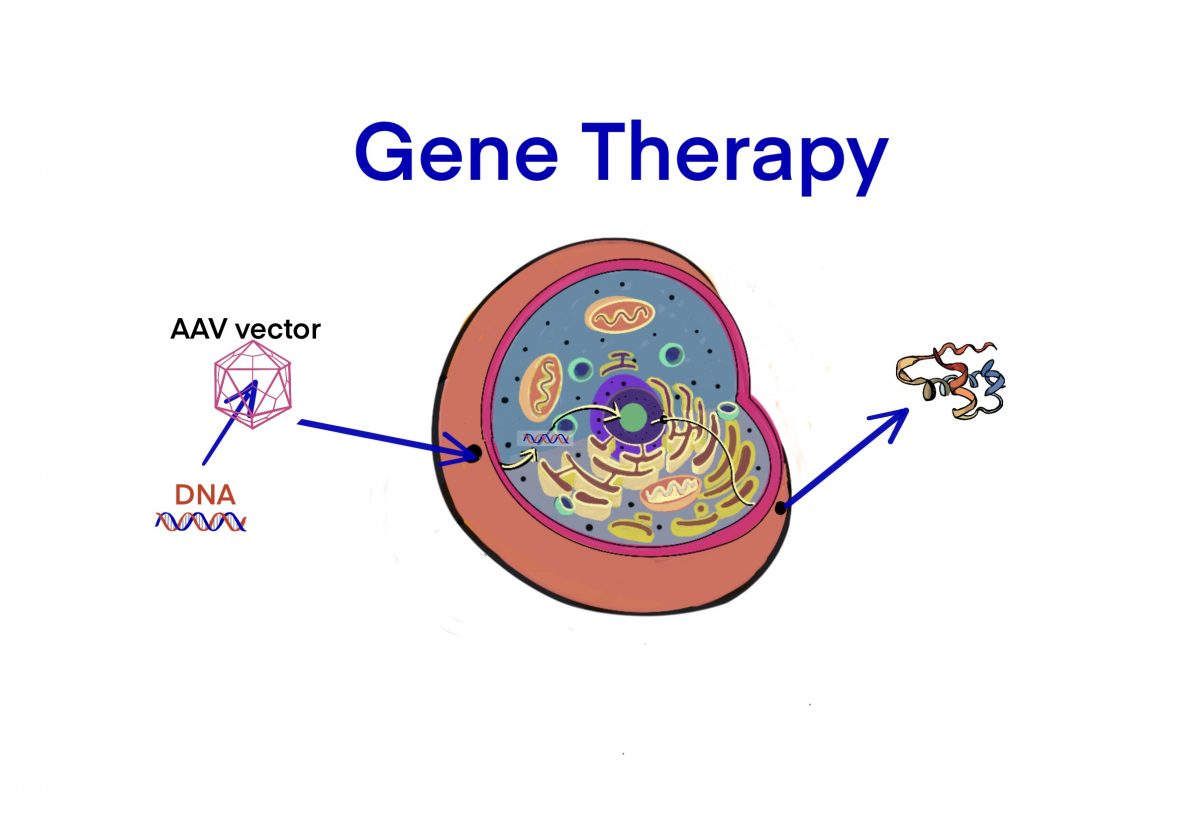
[Bio-Edu] AAV およびrAAV vector について- 長所/短所、立体構造、分子量および血中半減期 及び他ベクターとの比較[2020/11/05]
Post Views: 668 はじめに 遺伝子治療用に使用されるウイルスベクターには、AAVの他にLenti…
投稿者

-
[Data Link] rAAV vector/遺伝子治療薬に関する文献調査 [~2020/08/24] – ID2033 [2019/09/13]
Post Views: 437 Key Considerations in Gene Therapy Manu…
投稿者

-
[Bio-rAAV] アデノ随伴ウイルス(AAV)ベクターを使用する意義(特徴)と製造概要 – ID1862 [2019/09/06]
Post Views: 414 ID1862 rAAVベクターの特徴 遺伝子がランダムに導入される理由を掘り下…
投稿者

-
[GT] 現在の遺伝子治療の技術は目標半ば – その先の遺伝子治療技術 – ID1108 [2019/07/25]と[2025/04/14]の比較
Post Views: 579 2025/04での遺伝子治療は 以下,AIに聞いてみた.末尾には私が2019年…
投稿者

-
[Bio-Edu] rAAV vectorの製造・品質に関するリフレクションペーパー – [2019/07/21]
Post Views: 432 ID1065 リフレクションペーパー リフレクションペーパーとは、その後成熟し…
投稿者

-
[Edu] AAVウイルス感染のメカニズム – ID1039 [2025/04/14]
Post Views: 373 AAV(Adeno-Associated Virus, アデノ随伴ウイルス)は…
投稿者

-
[Bio-Edu] AAV2の感染に関わるレセプターは何か? – ID18442 [2019/07/20]
Post Views: 873 レセプターを考えるとき 生体内の物資が、特定の組織に収束するのは、受容体(re…
投稿者

-
[Bio-Edu] Bio Safety Levelとは – 遺伝子組換え実験と輸送など – カルタヘナ法に関わる – ID144 [2025/04/14]
Post Views: 492 はじめに バイオセーフティレベル(BSL)は、微生物・遺伝子組換え体などの生物…
投稿者