タグ: education
-
[Bio-Edu] 遺伝子組換え技術でタンパク質サンプルを得るまでのフローと装置 : 培養→精製→分析→保管 – ID9802 [2019/12/08]
Post Views: 727 原材料 USP(培養) バイオロジクスではUp Stream Process …
投稿者

-
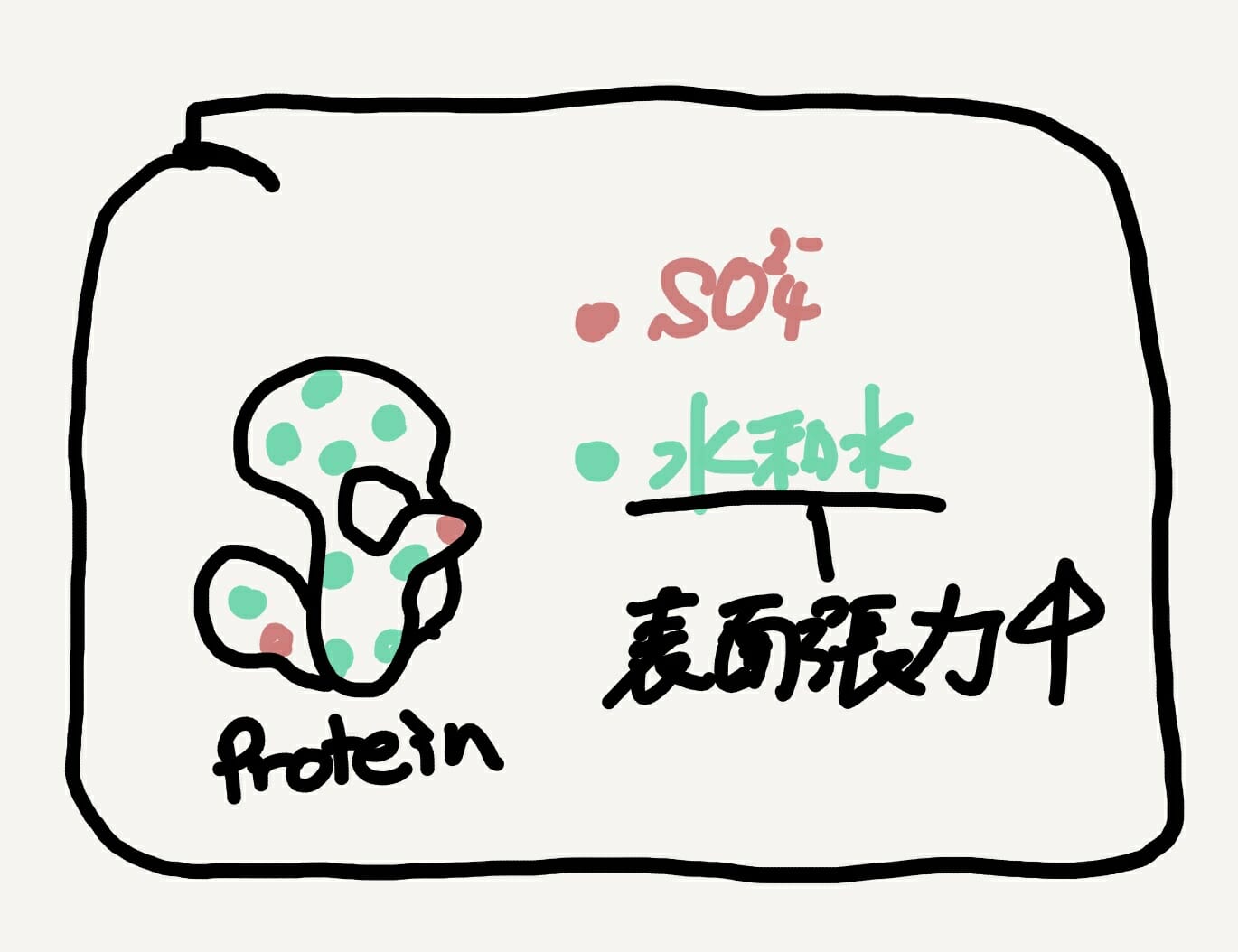
[Bio-Edu] 抗体のFc Domainに強い結合親和性を持つStaphylococcus aureus protein A (通称 Protein A)について – ID3817 [2019/12/03]
Post Views: 510 Protein A 抗体のFc領域に強い結合親和性を持つStaphylococ…
投稿者

-
[Bio-Edu] バイオロジクスのプロダクション培養において – 細胞内で起こる蛋白質の酸素を要する糖化(Glycosylation)と、還元酵素による分解に関する解説 – ID3160 [2021/01/20]
Post Views: 494 はじめに バイオロジクス(バイオ医薬品)の製造には、一般的に動物細胞が宿主とし…
投稿者

-
[Bio-Edu] 抗体医薬の脱アミド化を抑制するためのアミノ酸添加剤に関する特許出願 (アクテムラ)- 高濃度抗体含有溶液製剤, 2012 – ID3138 [2021/06/06]
Post Views: 502 脱アミド化を予防する製剤組成 抗IL-6受容体抗体に対して、50mM以上のアル…
投稿者

-
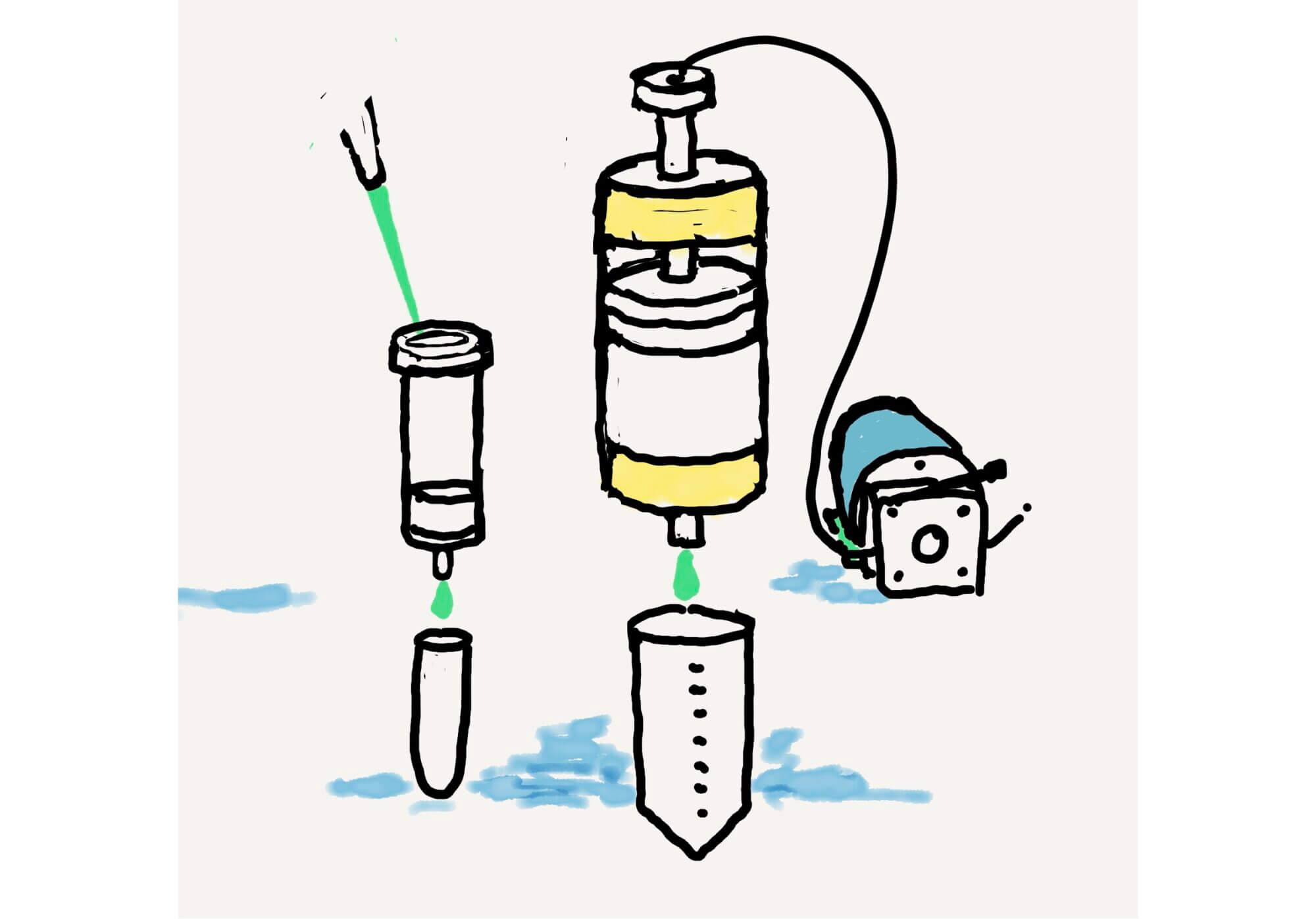
[Bio-Lab] マニュアル式のラボスケール・カラムクロマトで蛋白質精製の条件を検討する – ID3106 [工事中]
Post Views: 484 はじめに タンパク質精製の戦略 高価な装置が無くても始められる蛋白質の精製につ…
投稿者

-
[Bio-Edu] バイオロジクス高濃度化製剤, Sanofi (2015) – ID2711 [2019/10/14]
Post Views: 477 高濃度化する理由 静脈注射(IV)より皮下注射(SC)の方が便利: デバイスに…
投稿者

-
[Bio-Edu] 排除体積効果 – タンパク質を精製し濃縮する時に、知っておきたい知識 [2024/01/02更新] ID2701
Post Views: 856 はじめに バイオ医薬など高分子を取り扱う場合,排除体積効果について知っておかな…
投稿者

-
[Protein] Prothrombin; プロトロンビン/血液凝固因子 – ID2643 [2019/10/08]
Post Views: 472 ヒトプロトロンビン 分子量 72,000 Da 血中濃度 100m…
投稿者

-
[rAAV-Edu] rAAV9の精製方法 (ウイルスの一般的な精製方法を理解できる) – 特許,2018 – ID2559 [2023/10/23]
Post Views: 468 rAAV9 vectorの精製方法 培養液のバッファ組成をTFF処理で調整、硫…
投稿者