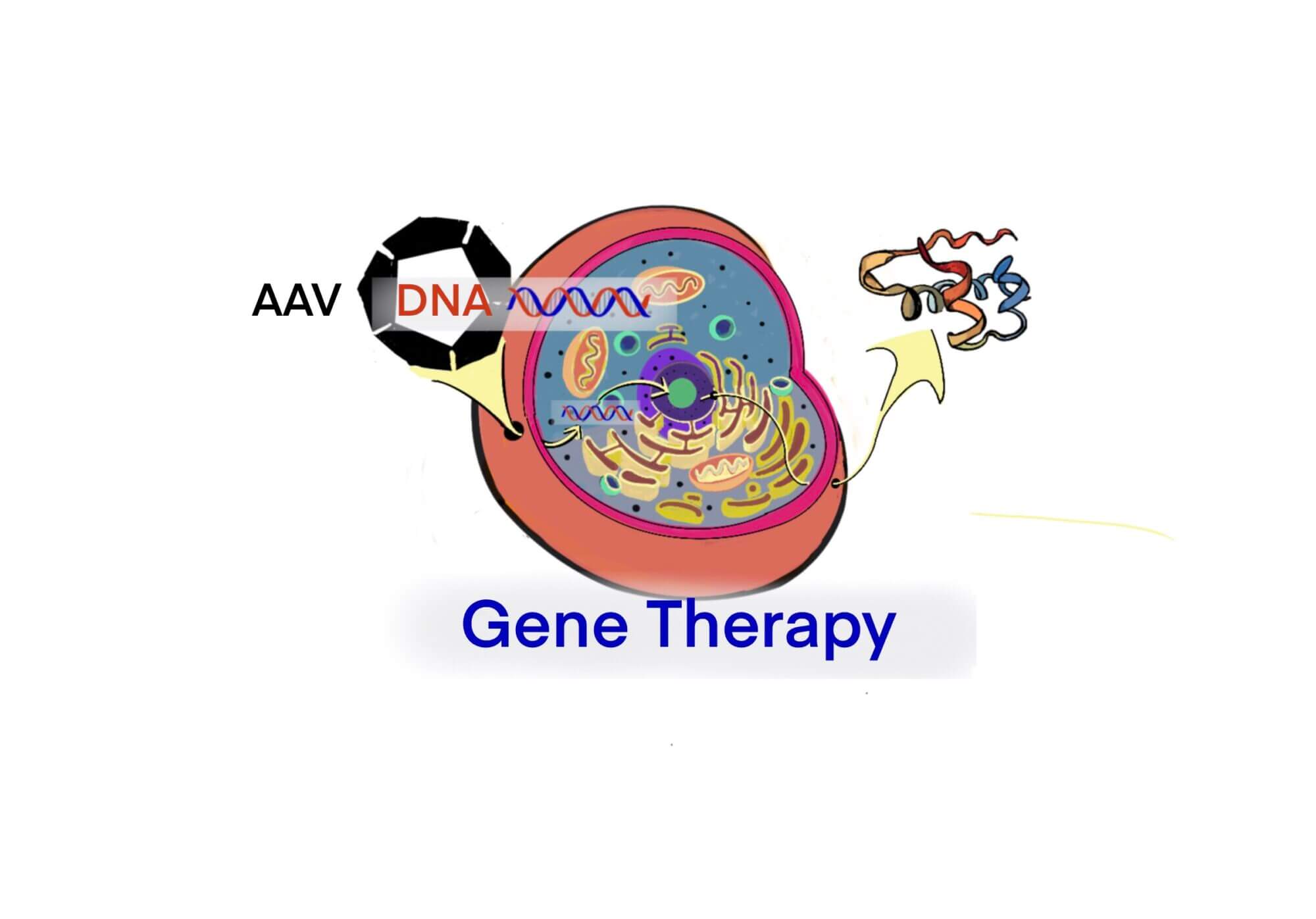
タグ: AAV
-
気になる企業 – Audentes Therapeutics – アステラス・グループ – ID4488 [2020/07/08]
Post Views: 558 Audentes アステラス製薬グループ (2019/12) Audentes…
投稿者

-
[Data Link] AAVベクター関連特許 – ID4163 [2019/12/09]
Post Views: 506 公開特許公報(A)_組換えAAV生産の効率を上昇させる方法 (2008) 神経…
投稿者

-
[Data Link] ウイルスベクターによる遺伝子導入と発現(4) – ID4158 [2019/12/09]
Post Views: 506 3.遺伝子導入と発現シリーズ ウイルスベクターによる遺伝子導入と発現(4)、三…
投稿者

-
調査 – 遺伝子治療 – LONZAの動向 – ID3803 [2020/05/07]
Post Views: 477 AAV AAVは、病原性が無いとされるウイルスである。正式名はAdeno As…
投稿者

-
[Bio-rAAV] rAAV vector製造でplasmidを細胞に導入するトランスフェクション試薬 – ID3336 [2020/07/21]
Post Views: 512 PEI Polyethylenimine (PEI)は、カルシウムよりも安定的…
投稿者

-
[rAAV] rAAVのUSP/DSP – 製造方法 – emptyとfullの比重, 2015 – SM[2019/10/05]
Post Views: 618 rAAVの製造 2015年時点のrAAV製造(Upstream, Downst…
投稿者

-
[rAAV-Edu] rAAV9の精製方法 – 特許, 2017 – ID2566 [2023/10/23]
Post Views: 483 概要 リコンビナントAAV(rAAV)の大規模精製方法に関する方法特許(Met…
投稿者

-
[rAAV-Edu] rAAV9の精製方法 (ウイルスの一般的な精製方法を理解できる) – 特許,2018 – ID2559 [2023/10/23]
Post Views: 469 rAAV9 vectorの精製方法 培養液のバッファ組成をTFF処理で調整、硫…
投稿者

-
[rAAV] rAAVの精製方法 – 澄明ろ過及び膜による – ID2532 [2019/11/05]
Post Views: 468 rAAVの精製方法 2016年の文献よりAAVの精製について解説する。また、P…
投稿者

-
[rAAV] Parvovirusに属するアデノ随伴ウイルス(AAV)をベクター(rAAV)にして遺伝子治療を行う — rAAVの特徴と臨床 (2003) – ID2516 [2019/10/02]
Post Views: 619 AAVベクター Adeno associated virus (AAV) ベク…
投稿者