タグ: AAV
-
気になる企業 – Molecular Medicine ;MolMed – [2020/11/09]
Post Views: 774 ID12516 MolMed イタリア ウイルス・ベクターを用いた遺伝子治療薬…
投稿者

-
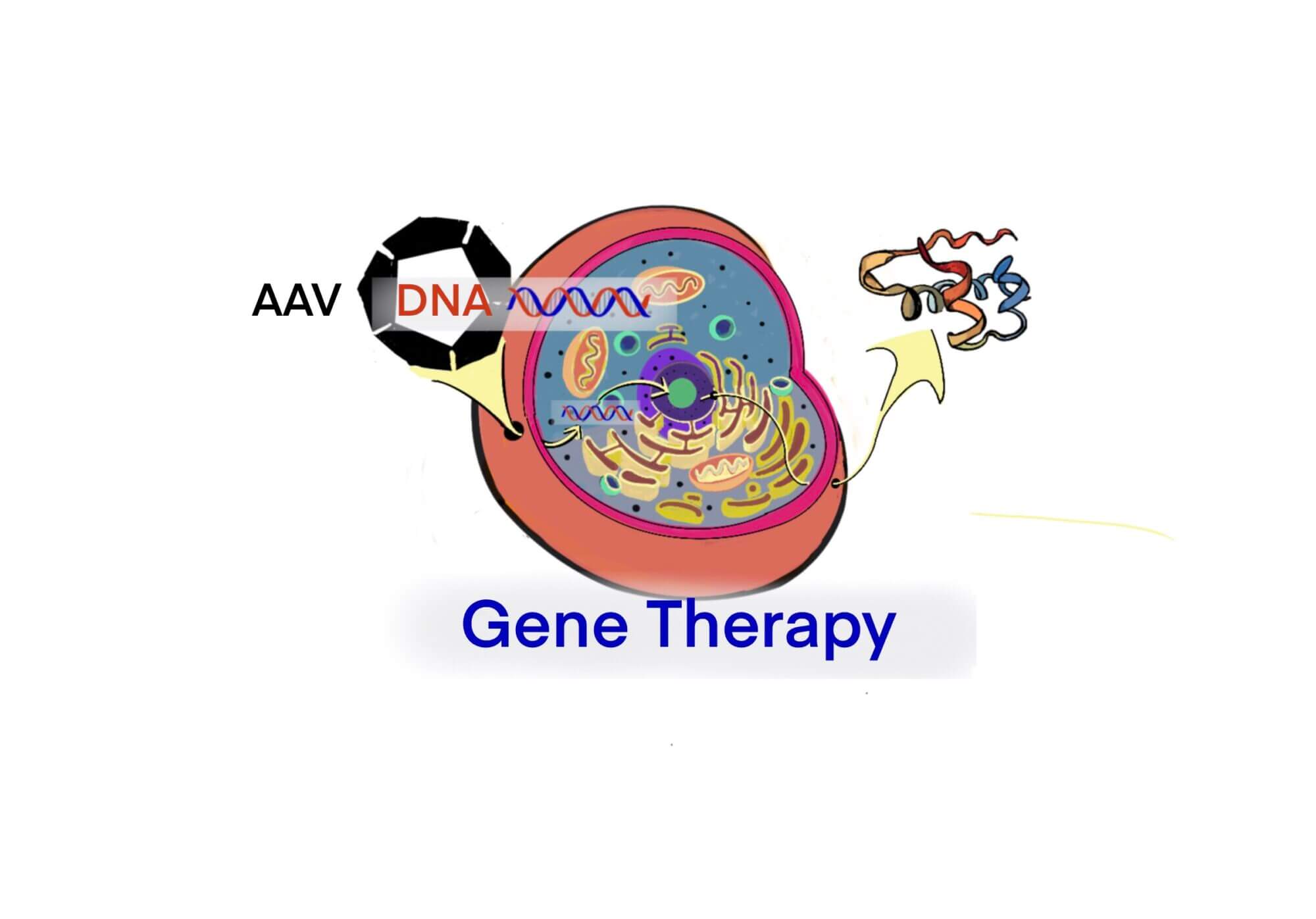
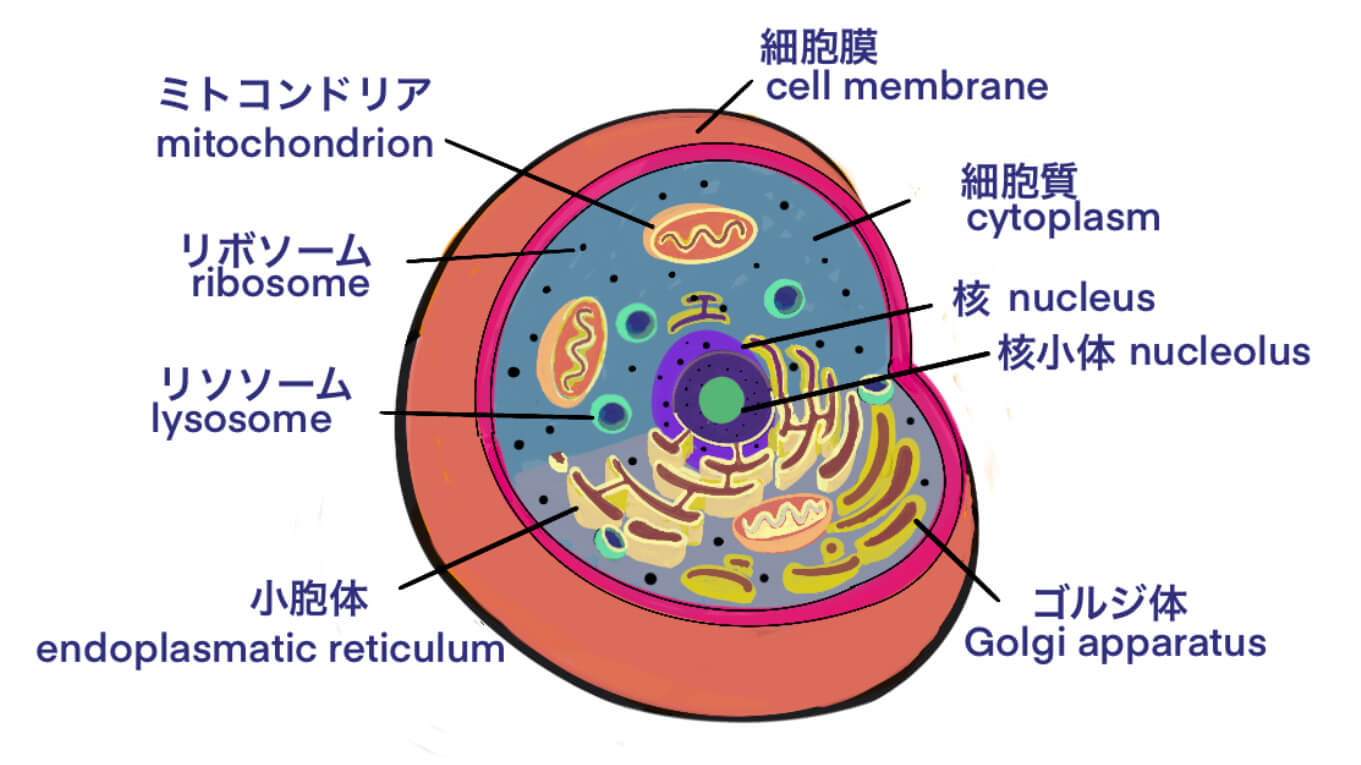
[Bio-Edu] ウイルスの等電点(pI) – 組換えAAVでは,empty/fullの違いでpIは異なる – 分離精製は工業化の課題である[2021/02/23]
Post Views: 1,226 はじめに 遺伝子治療用のウイルス・ベクターとしてAAVを使用した場合、目的…
投稿者

-
[遺伝子治療薬] ZOLGENSMA – AveXis-Novartis社が開発した筋萎縮性側索硬化症 (SMA)治療薬 – SM [2020/07/27]
Post Views: 1,075 筋萎縮性側索硬化症 筋萎縮性側索硬化症(Spinal Muscular A…
投稿者

-
[Bio-Material] Mustang® Q Membrane Units (2004) を使ったアプリケーション (Pall)
Post Views: 983 AAVの精製 Pall社の陰イオン交換体: Mustang Q membran…
投稿者

-
[遺伝子治療薬] ZOLGENSMA – スイスのノバルティス社(AveXis)が開発した遺伝子治療薬 [2020/06/22]
Post Views: 988 ZOLGENESMA スイスのノバルティス社(売上高約500億ドル, Inve…
投稿者

-
気になる企業 – Voyager Therapeutics – 中枢神経疾患の遺伝子治療薬の開発 – [2020/08/06]
Post Views: 894 ID20838 Voyager Therapeutics NASDAQ: VY…
投稿者

-
[Virus-Edu] 新型コロナウイルス(SARS-CoV-2)の感染機序 [2020/07/27]
新型コロナウイルス(SARS-CoV-2)の感染機序と、その感染機序から感染を阻止できると考えられるポイントに…
投稿者

-
[Vc] アデノウイルス・ベクター・ワクチンとは – 新型コロナウイルスのワクチン開発で威力を発揮する – 必要な遺伝子のみを残す試行錯誤で、現在は第三世代 [2021/02/26]
アデノウイルス・ベクターにいて、複数の文献を網羅的にレビューした英語の文献を基に、アデノウイルス・ベクターは、…
投稿者

-
[Bio-Edu] AAV血清型別の組織別の感染親和性 – 感染とインテグレーション [2023/10/31]
Post Views: 922 AAVの感染とは AAVのウイルス粒子表面を覆っているカプシドタンパク質の構造…
投稿者