はじめに
タンパク質精製の戦略
高価な装置が無くても始められる蛋白質の精製について解説する。
予算が少ない大学の研究室や高価な装置を整備できないベンチャーでの蛋白質精製について、タンパク質精製に関して初期教育、原理を理解しながらの目的蛋白質の精製サンプルの取得が可能である。
取り敢えず、1mLカラムでのスモールスケールによるサンプル調製から、400mLカラム程度のスケールアップも可能です。
初期のサンプル調製においては、クロマト装置は重厚長大です。使用前と後のシステムの洗浄など、結構面倒です。こんな初期に使うものではありません。
AKTAの出番は、その先に待っています。そもそもタンパク質精製は、集中して条件設定を実施し短期間で片付けるのです。
編集履歴
2019/11/10 はりきり(Mr)
2020/06/19 追加 (未完)
準備
情報収集
精製しようとしているタンパク質はなんですか? 精製タグは付いていますか? Refoldingは必要ないですか? 分子量を把握していますか? 等電点は? 疎水性?
タンパク質の情報
まずは、敵を知ることからです。情報を収集しましょう
- アミノ酸配列 : 以下の情報を知るために必要です
- 分子量
- 等電点
- 疎水性
- 精製タグ : 精製タグは、最大でもHis-tag程度にしておきましょう。その他精製タグは、物性を変化させたり、活性にも影響します
- His
- GST
- etc
出発材料
- 微生物
- E.coli
- 酵母
- 動物細胞
- CHO細胞
- HEK細胞
生産
- 微生物培養 → Inclusion Body(この解説では、これを前提)
- 動物細胞培養 → 培養上清
検討準備
目的蛋白質の測定法を考える (SDS-PAGE, ELISA, RPHA, 逆相HPLC、アフィニティカラム)
目的蛋白質についてRefoldingが必要か検討する。ここでは、Refoldingについては記載していない。
プレパックカラムは使わず、エンプティカラムにバルクのレジンを自己充填したカラムを使用する
クロマト装置は、基本的に必要ではなく、ピペット操作かペリスタリックポンプを使う
カラムサイズは、0.5mLから100mLを想定する。取得する蛋白質は、数mgから1g程度。
小さいカラムサイズでは、自然落下でクロマトを行う。
大きいカラムサイズではペリスタリックポンプを使用する
装置
SDS-PAGE装置
UVメーター(A280, A260なとを測定)
ピペット、チップ
ペリスタリックポンプ
- シリコンチュープ
- シリコングリス
pHメータ
試験管
- マルエムチューブSS14
- 50mM遠心管
手順
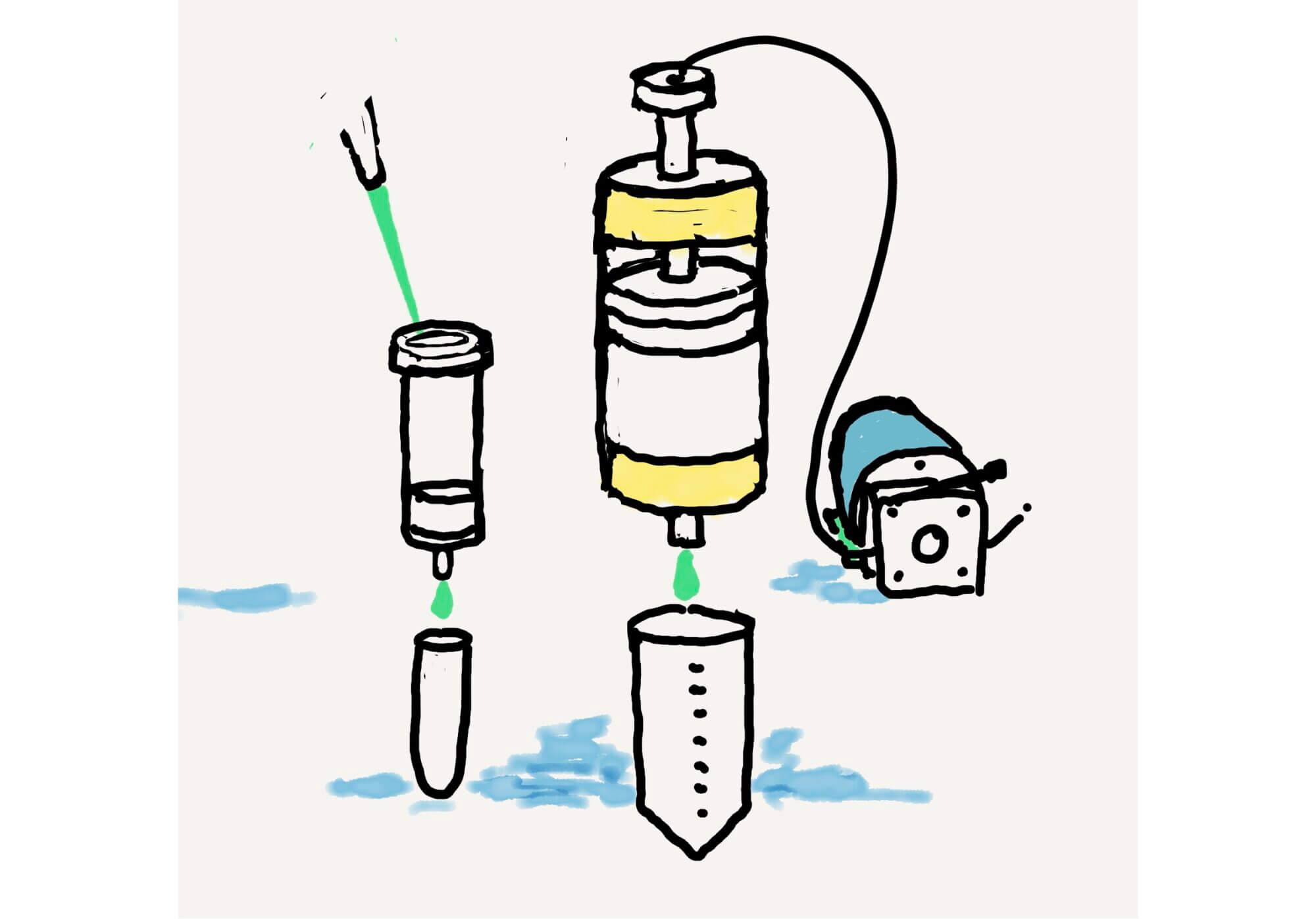
1. 手順 – 装置、カラムの充填及びカラムの取り回し(マニュアル)
GE HealthcareのEmpty Columnにレジンを充填(0.5mL or 1mL)
カラムクロマトは、自然落下による(線速は大きくなるが、レジンの最大キャパシティより1/3程度低いアプライ量で行うため、クロマト自体に問題は少ないが、常に考慮する必要がある点である)。
フラクション回収は、6カラムボリューム(CV)
6CV分のバッファを調整しておき、順次カラムにアプライしてカラムからでる液をチューブで回収する
2. 手順 – 吸着条件の決定
各種バッファの準備
水洗いしたバルクのレジンを使って0.5mLカラムの準備 30%から50%程度のスラリでカラム充填する
カラムの洗浄と平衡化
血漿や培養液の前処理してアプライサンプルを準備する : 水と酸及びアルカリにより電気伝導度とpHの調整
アプライサンプルのロードとパスした未吸着画分の回収及び目的蛋白質の測定 : 身吸着画分の量が多い場合は、未吸着画分に更に水と酸及びアルカリを添加して吸着しやすく調整し、その未吸着画分をそのまま再アプライする。満足する未吸着画分量から、水と酸及びアルカリでの調整量を最終決定する。
3. 手順 – 洗浄及び溶出条件の決定(1)
アプライpHと同じpHで、塩濃度を確認する : ベースバッファを作成し、3M NaClで段階的になるよう塩濃度の異なるバッファを作成し、順次カラムにアプライしフラクションを回収する。蛋白質量を測定し、目的の蛋白質が洗浄画分に溶出されない条件を洗浄画分に決定、溶出が完了する条件を溶出条件に決定する。
4. 手順 – 強固に結合した目的物と不純物の存在について心証をえるための操作
6M 塩酸グアニジン(GuHCl)を0.5CVアプライ、水を5.5CVアプライし全てを回収する。この画分は、アプライサンプル、洗浄画分、溶出画分と一緒にSDS-PAGE分析を行う。目的蛋白質の染色バンドと同位置に対して、6M GuHCl画分にどれくらいの割合が含まれているか、不純物はどれくらいの割合が含まれているか確認する。
6M GuHCl画分中に容認できない量の目的蛋白質が含まれていた場合、上述の手順で6M GuHClの手前までの手順を再度実施する。その後、以下の手順に従い最適な溶出pHを決定する。
5. 手順 – 溶出条件の決定(2)
pHを上げるか下げるか方針を決定する。カラム内の塩濃度を下げるために水6CV添加する。溶出条件の決定(1)で実施したようにバッファを作成するが、今度は、異なるpHでNaCl濃度を決定していく。最後に6M GuHCl画分を回収し、前回と同様にSDS-PAGEを行い溶出効果の違いを確認する。洗浄する場合のpH及び溶出する場合のpHを、この検討から決定することができる。もしかすると洗浄のpHは溶出のpHと異なることもある。
今後、各手順の詳細や根拠は随時アップデートする予定、2019/11/10 by はりきり(Mr)
高価な装置が無くても始められる蛋白質の精製
マニュアル操作によるカラムクロマト条件の決定
蛋白質の精製を行おうと思う時は、その必要性に迫られてのことだと思うので、原材料は準備されているとの前提で、以下話を進めます。装置の洗浄やその他準備が必要ないため小回りが効き短時間で条件設定し精製品を取得できる
大学や高価な装置を整備できないベンチャーでの蛋白質精製についての初期教育はもとより目的蛋白質の精製品の取得に役立つ。例えば、ツール蛋白質の取得には有効である。
準備
目的蛋白質の測定法を考える (SDS-PAGE, ELISA, RPHA, 逆相HPLC、アフィニティカラム)
目的蛋白質についてRefoldingが必要か検討する。ここでは、Refoldingについては記載していない。
プレパックカラムは使わず、エンプティカラムにバルクのレジンを自己充填したカラムを使用する
クロマト装置は、基本的に必要ではなく、ピペット操作かペリスタリックポンプを使う
カラムサイズとして0.5mLから100mLは対応可能(数mgから1g程度まで取得可能。小さいカラムサイズでは、自然落下でクロマトを行う。大きいカラムサイズではペリスタリックポンプを使用する
手順
1. 手順 – 装置、カラムの充填及びカラムの取り回し(マニュアル)
SDS-PAGE装置
UVメーター(A280, A260なとを測定)
ピペット、チップ
ペリスタリックポンプ、シリコンチュープ、シリコングリス
HORIBA ハンディpHメータ及び伝道度メータ
マルエムチューブSS14, 50mM遠心管
GE HealthcareのEmpty Columnにレジンを充填(0.5mL or 1mL)
カラムクロマトは、自然落下による(線速は大きくなるが、レジンの最大キャパシティより1/3程度低いアプライ量で行うため、クロマト自体に問題は少ないが、常に考慮する必要がある点である)。
フラクション回収は、6カラムボリューム(CV)
6CV分のバッファを調整しておき、順次カラムにアプライしてカラムからでる液をチューブで回収する
2. 手順 – 吸着条件の決定
各種バッファの準備
水洗いしたバルクのレジンを使って0.5mLカラムの準備 30%から50%程度のスラリでカラム充填する
カラムの洗浄と平衡化
血漿や培養液の前処理してアプライサンプルを準備する : 水と酸及びアルカリにより電気伝導度とpHの調整
アプライサンプルのロードとパスした未吸着画分の回収及び目的蛋白質の測定 : 身吸着画分の量が多い場合は、未吸着画分に更に水と酸及びアルカリを添加して吸着しやすく調整し、その未吸着画分をそのまま再アプライする。満足する未吸着画分量から、水と酸及びアルカリでの調整量を最終決定する。
3. 手順 – 洗浄及び溶出条件の決定(1)
アプライpHと同じpHで、塩濃度を確認する : ベースバッファを作成し、3M NaClで段階的になるよう塩濃度の異なるバッファを作成し、順次カラムにアプライしフラクションを回収する。蛋白質量を測定し、目的の蛋白質が洗浄画分に溶出されない条件を洗浄画分に決定、溶出が完了する条件を溶出条件に決定する。
4. 手順 – 強固に結合した目的物と不純物の存在について心証をえるための操作
6M 塩酸グアニジン(GuHCl)を0.5CVアプライ、水を5.5CVアプライし全てを回収する。この画分は、アプライサンプル、洗浄画分、溶出画分と一緒にSDS-PAGE分析を行う。目的蛋白質の染色バンドと同位置に対して、6M GuHCl画分にどれくらいの割合が含まれているか、不純物はどれくらいの割合が含まれているか確認する。
6M GuHCl画分中に容認できない量の目的蛋白質が含まれていた場合、上述の手順で6M GuHClの手前までの手順を再度実施する。その後、以下の手順に従い最適な溶出pHを決定する。
5. 手順 – 溶出条件の決定(2)
pHを上げるか下げるか方針を決定する。カラム内の塩濃度を下げるために水6CV添加する。溶出条件の決定(1)で実施したようにバッファを作成するが、今度は、異なるpHでNaCl濃度を決定していく。最後に6M GuHCl画分を回収し、前回と同様にSDS-PAGEを行い溶出効果の違いを確認する。洗浄する場合のpH及び溶出する場合のpHを、この検討から決定することができる。もしかすると洗浄のpHは溶出のpHと異なることもある。
今後、各手順の詳細や根拠は随時アップデートする予定、2019/11/10 by はりきり(Mr)