ID19527
ワクチンの臨床結果による有効性の比較
世界の製薬企業であるPfizer, ModernaおよびAstrazenecaの臨床試験の成績の比較は、以下のをご参考にしてください。
Moderna社のCOVID-19/Phase I Preliminary Report
COVID-19ワクチン
Modernaが開発しているmRNAを用いたCOVID-19ワクチンの臨床結果について途中結果が出ています。
- 2021/05/23, インド変異株(デルタ株)に対する有効性について、1摂取では、AstrazenecaとPfizerとも33%, 2回摂取でAstrazenecaは60%, Pfizerは88%であると、イングランド公衆衛生庁(PHE)が発表, BBC News(ファイザー製とアストラゼネカ製ワクチン、2回接種でインド型変異株に有効=英研究, 2021/05/23))
- 2020/12/17, mRNA-1273の臨床結果の詳細 : 3つの年齢層にわたる4つの用量レベルのmRNA-1273の安全性と免疫原性を評価、有効性の評価では94.1% (Vaccine Efficacy)と評価された。
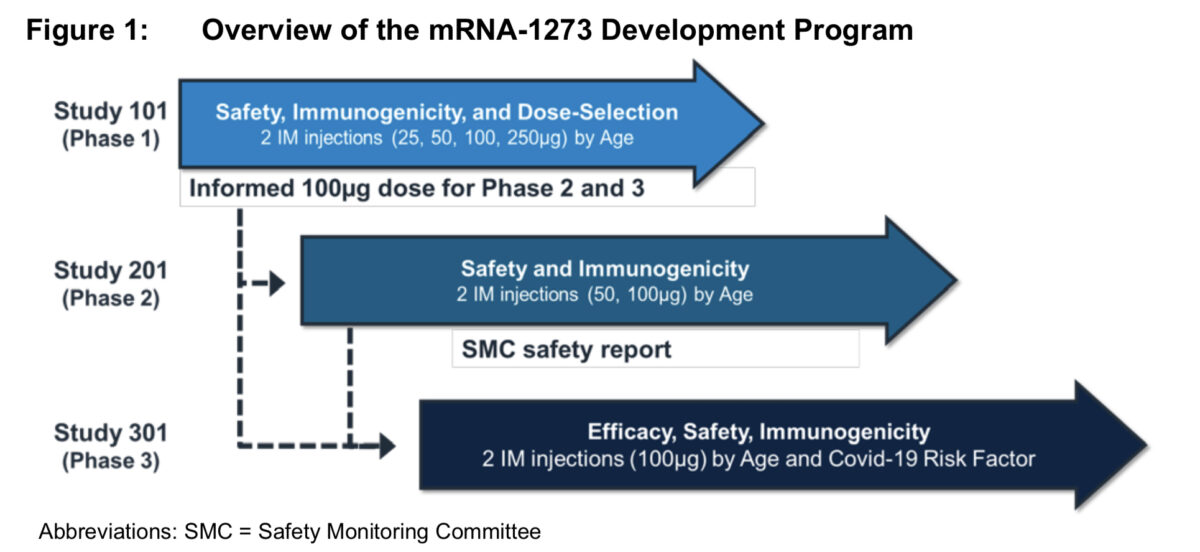
- Study 101
- デザイン : 非盲検の進行中の第1相用量設定試
- 結果 : フェーズ2およびフェーズ3の研究で使用される100μgの用量の推奨容量を得た
- Study 201
- デザイン : ランダム化プラセボ対照の安全性および免疫原性試験
- 結果 : 大規模な第3相試験である試験301の開始をサポートする追加の安全性データを取得
- Study 301
- デザイン: 30,000人以上で、有効性、安全性、および免疫原性評価、ランダム化プラセボ対照試験
- Study 101
MRNA-1273 SPONSOR BRIEFING DOCUMENT VACCINES AND RELATED BIOLOGICAL
https://www.fda.gov/media/144452/download
– MEETING DATE: 17 DECEMBER 2020 AVAILABLE FOR PUBLIC RELEASE –
- 2020/11/16, Phase 3(30,000人以上を予定)の中間結果(95人に実薬投与、90人プラセボ)、94.5%の有効性が示された。2020年末までに、2,000万回分の提供を予定している source。
An mRNA Vaccine against SARS-CoV-2 — Preliminary Report
https://www.nejm.org/doi/full/10.1056/NEJMoa2022483
- 2020/07/14
- ワクチン : mRNA-1273 (S-2P antigen encoded), as SARS-CoV-2 spike protein encoded
- 投与 : 0.5mL (deltoid muscle), days 1 and 29
- Phase 1 : 45人、18 ~ 55 years of age, 28 days
- 評価: Anti-S-2P antibody geometric mean titer(GMT) ELISA
- 以下の29日と57日のデータから投与量が多いほど、抗体価が上昇しているのがわかる
- 29 Days
- 25μg: 40,227
- 100μg: 109,209
- 250μg: 213,526
- 57 Days
- 25μg: 299,751
- 100μg: 782,719
- 250μg: 1,192,154
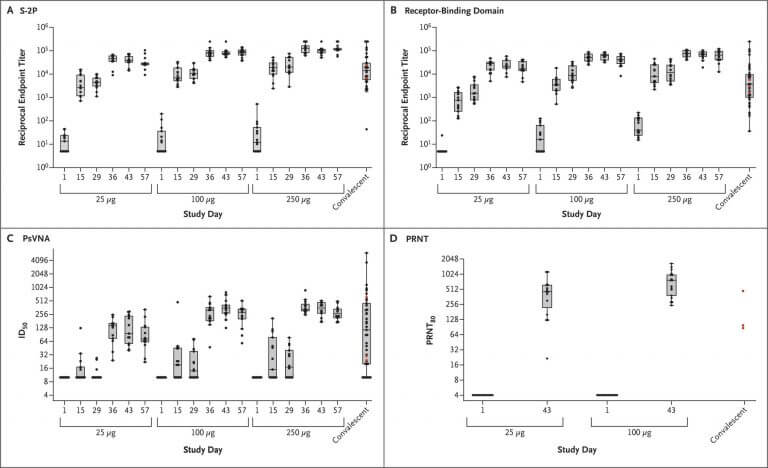
Good agreement was noted within and between the values from binding assays for S-2P and receptor-binding domain and neutralizing activity measured by PsVNA and PRNT
Safty
- 有害事象が低い確率
- Fever (発熱)
- Arthralgia (関節痛)
- Nausea (吐き気)
- Chills (悪寒)
- Size of erythema or redness (紅斑または発赤)
- Size of induration or welling (
- 有害事情が中程度の確率
- Fatigue (倦怠感)
- Headche (頭痛)
- Myalgia (筋肉痛)
- 有害事象が高い確率
- Any systemic symptom (全身症状)
- Any local symptom (局所症状)
- Pain (痛み)
編集履歴 2020/07/24 はりきり(Mr) Phase Iについて 2020/11/16 追記 (Phase 3中間報告で94.5%の有効性)
