mAbの不安定性
mAbの不安定性に関する論文をもとに、レジメとしてまとめた。関連する情報は,末尾の文献リストに記する.
Physicochemical Stability of Monoclonal Antibodies: A Review, Published: August 26, 2019 – Journal of Pharmaceutical Sciences
https://jpharmsci.org/article/S0022-3549(19)30506-4/fulltext
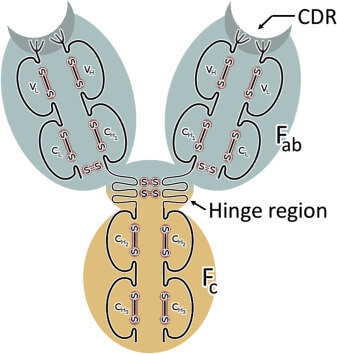
IgG抗体の構造
バイオ医薬品は、遺伝子組換え技術の発展とともに80年代以降劇的に拡大しました。モノクローナル抗体(mAb)は、ジスルフィド架橋で連結された4本の鎖(2本の軽鎖と2本の重鎖)で構成されるタンパク質です。
- 軽鎖は、2つのドメインからなっている
- 重鎖は、4つのドメインからなっている
- 抗体の結合機能を有する腕 (Fab) は、軽鎖の2ドメインと重鎖の2ドメインで構成される
- 直接抗原と接触して結合する領域5~10程度のアミノ酸を含む相補的決定領域 (CDR; complementarity-determining region)は、可変領域(Fv)と呼ばれ、軽鎖と重鎖のそれぞれに3つずつ(CDR1~CDR3)存在する。
- 各ドメインは、SS結合により固い構造になっている
- 重鎖は、Hinge regionでCDR側とFc側に分かれている
- Hinge Regionは、重鎖同士をSS結合している
抗体の種類
アイソタイプ
- IgG : 抗体医薬に用いられる
- IgG1: 一般的な抗体医薬
- IgG2
- IgG3
- IgG4: ADCC活性が低い
- IgA : 粘液関連
- IgM : 初期反応
- IgE : アレルギー関連
- IgD : 高IgD血漿
サブタイプ
アイソタイプは、Hinge RegionのSS結合の数などで分類される。
翻訳後修飾の違い
抗体の生産細胞株は、一品物です。低分子医薬品でいうジェネリックというものは、バイオ医薬品にないのはそのためです。代わりに「バイオシミラー」と呼ばれるものがあります。遺伝子配列上で同じで合っても、作り直されたバイオ医薬品は、生産細胞株の違いから、翻訳後修飾に違い(例えばグルコシル化の違い)が生じます。
バイオシミラーの類似性
- 構造 structure
- 生物活性 biological activity
- 有効性 efficacy
- 安全性 safety
- 免疫原性プロファイル immunogenicity profile
バイオシミラーの承認要件
- 分析 (物理科学的および生物学的)
- 臨床 (薬物動態、pharmacodynamics)
- 安全性 safety
- 効力 potency
不安定化の局面
- 容器の移し替え
- 凍結
- 静脈投与時の輸液による希釈と投与ラインへの接触
原因
安定性に影響する要因(input factor)が、以下のように考えられます。
- タンパク質の構造(物性)
- 濃度
- 界面
- 光暴露
- 賦形剤と不純物
- 攪拌
結果
Input factorによって影響を受けたmAbへの変化は、Output factorとして以下のような項目が考えられます。
- 凝集
- 断片化 (ペプチド、糖鎖)
- 構造変化(1次、2次、3次など)
不安定化のメカニズム
- 化学的
- 等電pH; 等電点(pI)の変化
- CDRへの影響 : 結合活性
- Fcへの影響 : FcRn結合性
- SS結合の形成を含む酸化
- 酸化剤 (過酸化物、光、金属)の有無
- 酸化
- 酸化またはコハク酸イミドの形成による全体的な正電荷の増加 (pI増加)
- mAb血中半減期の減少、皮下バイオアベイラビリティの変化
- 2つのさんがされた遊離残基の間に発生したするシステイン酸化の結果
- チオレートアニオン中間体を伴う
- 酸化されやすいアミノ酸残基
- メチオニン
- 二次構造の不安定化による凝集の可能性
- ヒスチジン
- システイン
- メチオニン
- 脱アミド (酸塩基反応)
- 全体的な負電荷の増加(pIの減少)→クリアランス増加
- プロトンドナー(スレオニン、セリン)による促進
- 環状ペプチド中間体の形成 → ポリペプチド構造に歪み
- 影響を受けるアミノ酸
- アスパラギン
- スクシンイミド中間体は、アスパラギン酸/イソアスパラギン酸を自発的加水分解する
- グルタミン酸
- アスパラギン
- 断片化
- 発生する箇所
- ジスルフィド結合
- ワンアーム
- 遊離軽鎖
- ペプチド結合
- (非)酵素的分解
- Hinge region (パパイン消化部位)
- アスパラギン/アスパラギン酸
- スクシンイミド中間体を介した自然加水分解の影響を受けやすい(高温の場合)
- ジスルフィド結合
- 発生する箇所
- 糖化
- メイラード反応
- メイラード反応とは: 還元糖とアミノ化合物を一緒に加熱し褐色物質(メラノイジン)を生じる反応.褐変反応ともいう.アミノ化合物とは,アミノ酸,ペプチド,タンパク質.(source by wikipedia).
- アマドリ転移で安定かしたケトアミン形成→構造・機能に影響
- シッフ塩基形成→還元糖とタンパク質が結合
- 現在、非還元糖の添加で予防
- 但し、非還元糖の分解により還元糖が生じる
- メイラード反応
- 物理的
- アンフォールディング
- 高次構造の喪失
- 化学的条件下による誘発
- Hingeの柔軟性の低下、凝集促進
- 凝集体
- 一次構造は変化しない
- 弱い非得意的結合
- ファンデンワールス相互作用
- 水素結合
- 疎水結合
- 静電相互作用
- 共有結合凝集体
- SS結合を含む
- 不可逆的凝集
- Lumry-Eyringモデル
- 内山モデル
- 免疫原性
- 抗体の中和による活性低下
- 内因性との交差反応によるIgEを介した過敏症、アナフィラキシー
- 因子
- 凝集体サイズ
- 10μm : 非経口製剤, 第8版 欧州薬局方。巻。8.4。2015年:5013 -5015https://www.edqm.eu
- 25μm : 粒子汚染-目に見えない粒子。で:第8版 欧州薬局方。巻。8.0。2011:342-344https://www.edqm.eu
- グリコシル化の程度
- 不純物
- 凝集体サイズ
- B細胞受容体とのクロスリンク
- Tヘルパー細胞依存性: 抗原提示
- Tヘルパー細胞非依存性: サイトカイン活性化
- アンフォールディング
- タンパク質構造
- CDRの低いpI
- 可溶性凝集隊の形成を促進
- CDRの高いpI
- 特に負に帯電した表面と接触している場合、不溶性凝集体の形成
- IgG1, IgG2, IgG4のLow pH 処理(pH3.3)後、中性に戻す
- IgG1は、monomerのまま
- IgG2, IgG4は、2段階のオリゴマー化プロセスを経て、IgG4では、凝集に至った(59)
- Hingeの柔軟性の増加に関わっている
- Fc領域のアンフォールディングがトリガー
- 結論
- 凝集しにくい : IgG1 < IgG2 < IgG4 : 凝集しやすい
- タンパク質のフォールディングが、完全に折り畳まれているnative状態から完全なunfolding状態がある時、中間の状態である部分的な折り畳み状態では、凝集しやすい(24, 47)
- CDRの低いpI
- タンパク質濃度と自己会合
- タンパク質濃度の低下は、弱く結合した凝集体の乖離につながる
- 一般的に高い濃度は、凝集につながるとされるが、高い濃度による粘度の増加により凝集を促進させた結果や逆に凝集率を低下させる結果などの報告がある
- 賦形剤とmAbの比率を変更せずに希釈していくと、賦形剤濃度が低下することで、電解組成を低下させてしまうことで安定性の低下を招く可能性がある(17)
- イオン強度は、粘土に影響し自己会合に影響する
- タンパク質の等電点(pI)付近では、電荷が減少することで反発する静電相互作用が減少する。これにより、粘度がが最大になる可能性がある
- 自己会合ポテンシャルは、浸透第二ビリアル係数(非理想解の尺度)と拡散相互作用パラメータ(分子間相互作用の定量化、浸透第二ビリアル係数の成分)によって予測できる
- dynamic Light Scattering (DLS)
- self-interaction chromatography
- 浸透第二ビリアル係数が強い負の場合、多量体を形成する可能性が高い : 溶質分子間の正味の引力/反発力を示すため(71)
- ゼータ電位は、表面電荷(静電相互作用、ファンデルワールス)の良い指標
- 温度
- 固有のTm (平衡融解温度)
- 立体構造の破壊は、Tmよりはるかに低い温度から始まる。なぜなら、Tmは、50%ののタンパク質の立体構造が壊れた温度を示すため
- 一般的に、40℃から80℃
- 一般的バイオ医薬品の保存温度は、2~8℃あるが,一部のバイオ医薬品,例えばmRNAワクチンなどは,薬効優先戦略を取り剤形をナノパーティクルとしたため,超低温での保存でしか安定性を確保できない薬剤もある.
- 高温
- 不可逆的立体構造の破壊
- 脱アミド(アスパラギン,グルタミンのアミドを含む側鎖の分解 by source)
- 酸化 (一般的には,アミノ酸であるメチオニンの酸化を意味する)
- 低温
- 緩衝液のpHの変化
- 低温濃縮
- 界面の形成(水/氷) → 凝集体が生じやすい
- コロイドとタンパク質の立体配座の安定性の違い
- 凍結融解の回数増加によりmonomer SEC peakの減少(76)
- 加熱・冷却の到達温度までの速度
- mAbは、他のタンパク質に比べて短期の温度変化に強い
- 固有のTm (平衡融解温度)
- タンターフェース(吸着)
- タンパク質表面の電荷、疎水性に関係する
- 一次包装である比較的不活性なType I ガラス容器でも、比較的大量のタンパク質を吸着できる
- 静電相互作用による
- 二次構造の変化はない
- ポリ塩化ピニル(PVC)またはポリオレフィンIVバッグ保管
- 1mg/mL IgG4, 1~6時間保存で25%減少し、目に見えない粒子の増加
- PS20を添加すると改善する(ただし、PS20は、可塑剤の溶出を増やす)
- Fabとポリスチレン(PS)
- PS表面に単層のタンパク質層が形成
- 空気
- 空気は、水分と比較して相対的に疎水性である
- 水と空気との海面で吸着して層を形成する可能性がある(83)
- IVバッグからベッドスペースを無くす
- PSの有無に関わりなく攪拌で誘導される凝集体形成が減少する
- シリコンオイル
- 潤滑剤として使用
- タンパク質のシリコン油層への吸着→粘弾性ゲル層形成(タンパク質濃度依存)
- 粘弾性ゲルの破壊は、凝集体の拡散となる
- 攪拌、最適でないpHで増強
- 界面活性剤の添加で抑制
- 適切な量が望まれる
- 0.01mg/mL in 0.9% NaCl を PES膜によるろ過
- PESおよびポリアミドは正に帯電してお、mAbが吸着した
- 5% Glucoseを展開すると吸着減少
- 不動態化(surface passivation, 表面コーティング)
- 単相コーティング
- 多層コーティング
- 水素結合供与体が少なく、水素結合受容体が多いポリマーを使用すると吸着が少なくなる
- 光
- 光酸化
- 酸素化ラジカル
- 光分解
- 精製過程での検出器による光
- 環境下の光
- 液体より凍結乾燥体の方が弱い(108)
- 芳香属アミノ酸は光に敏感
- トリプトファン(UV光に弱い)
- 100mg/mL IgGと8000Lxの白色光, ICH Q1B(30~78h, 推奨事項132万Lx) → 褐色
- 純度低下
- monomer低下
- アミノ酸の酸化
- 活性の低下
- 暴露総量に依存する(112)
- 製材組成も影響を受ける
- PSの自動酸化
- 光酸化ヒスチジンは、ヒスチジンと架橋
- 賦形剤
- pHは、タンパク質のタイプ(正/負)と総電荷により決定
- 高いpHは、脱アミド、酸化を促進する可能性があり、重合化の可能性がある
- pH5-6では、断片化を抑制するが、
- 更に低いpHは、切断、異性化を引き起こす可能性
- Aspの断片化は、<pH5で発生
- 塩はタンパク質に結合(電荷シールド)することで、粘度低下を起こし、コロイド安定性を改善する可能性がある。同時に、タンパク質濃度が高いと短距離疎水性相互作用を起こすため溶解度の低下の可能性がある(塩析効果)
- ベンジルアルコール (benzyl alcohol)は、凝集促進する
- 界面活性剤で最も凝集に保護的な物(科学的シャペロン)は、polysorbate (PS) 80 (PS80)、polysorbate 20 (PS20)と比較してしても構造安定性への影響が少ない
- PS20のミセル濃度と凝集抑制を検討した研究では、ミセル濃度に関係なく、シリコンによる凝集を抑制したことから、臨界ミセル濃度とは関係なく、タンパク質相互作用を阻害するとされる
- 界面活性剤は、折り畳まれていないタンパク質に優先的に結合することで、天然の状態のタンパク質の安定性へ影響する可能性がある(47)
- 1% w/v PS80は、強い光の暴露で劣化し自動酸化による過酸化物の量(メチオニン、トリプトファンの酸化)の増加が見られたという結果がある
- エデト酸2ナトリウム(edetate disodium)は,カルシウムのキレートにより,汚染の可能性のある宿主細胞由来リパーゼによるPSの加水分解を阻害する
- PS自体からの遊離脂肪酸粒子の形成の可能性
- PSは、Fc領域に優先的に結合する
- 界面活性剤に似たシクロデキストリンは、毒性が少なく、過酸化物の生成がなく、タンパク質への影響がないためPSの代替物になり得る。10mM ヒドロキシプロピル-β-シクロデキストリンは、凝集体を抑制したとする
- 糖とポリオール
- 熱力学的安定性の向上(143)
- 凍結乾燥品での安定性(144)
- スクロースが使用されるが、グルコースとフルクトースに加水分解される可能性(低pH)があ理、糖化の可能性がある
- ヒトでの使用登録に無い物
- トレハロースなどの非還元糖は、メイラード反応しない
- メリビオースを含むリツキシマブ製剤がある
- マンニトールは、結晶化の可能性があり、使いづらい
- アミノ酸
- アルギニン : 酢酸塩、グルタミン酸アルギニン塩は、IgG1に安定的であったが、塩化物、硫酸ナトリウムアルギニン塩では、安定性は低下してした
- ヒスチジン : mAb製剤の緩衝液としてよく使用される
- プロリン : 環状アミノ酸であり、タンパク質の芳香族残基と疎水性領域に結合することでmAbの可溶性を高める
- グリシン : マンニトールに似て凍結乾燥製剤でアモルファイ状態のままであると凝集を抑制する
- メチオニン : 光分解から保護する可能性がある
- 金属イオン
- 断片化とフリーラジカルを生じる (銅)
- 断片の影響がなかった金属
- 亜鉛、マグネシウム、、ニッケル、コバルト、マンガン
- バッファ種によて影響が異なる
- タングステン : アンフォールディング、凝集
- 対策は、キレート剤
以上
まとめ
抗体医薬は最も研究が進んだバイオ医薬品であり,タンパク質医薬品として沢山の研究がなされており,タンパク質であるその他のバイオ医薬品のための開発に欠かせない有用な情報原である.
編集履歴
2020/07/26 Mr. Harikiri
2022/10/23 文言整備,追記 : メイラード反応および関連文献
参考文献
メイラード反応による免疫原性の向上に関する文献
メイラード反応による食物アレルゲンの糖化は、そのT細胞免疫原性を高めます:マクロファージスカベンジャー受容体クラスAタイプIおよびIIの役割 – The Journal of allergy and climical immunology 2010Jan01 Vol. 125 issue(1) –
[概要]
https://bibgraph.hpcr.jp/abst/pubmed/19864011?click_by=p_ref
オブアルブミン(OVA)とグルコースをメイラード反応させたAGE-OVAは,CD4(+) T細胞の活性を増強させた
メイラード反応による免疫原性の低下に関する文献
メイラード反応により糖鎖修飾したソバ全タンパク質が脾臓細胞の免疫応答に及ぼす影響
[概要]
Fag e 1にグルコマンナンやキシログルガン等の多糖鎖を付加するとソバアレルギー患者血清中のIgE抗体にたいする反応性が顕著に低下する[keyword]
chrome-extension://efaidnbmnnnibpcajpcglclefindmkaj/https://www.jstage.jst.go.jp/article/jjfcs/23/2/23_90/_pdf
データベースに登録されているソバアレルゲン名: Fag e 1~
メイラード反応における反応は主にリジン
加工処理中に起こるメイラード反応がエビ・カニ筋肉の消化性とアレルゲン性に及ぼす影響 – 北海道大学・大学院水産化学研究部 –
[概要]
chrome-extension://efaidnbmnnnibpcajpcglclefindmkaj/https://www.sapporoholdings.jp/foundation/record/list/2017/pdf/list_2017_04.pdf
メイラード反応条件(60℃,相対湿度35% or 65%)
特異的IgE(CAP-アレルゲン)のAllergen種類
ビール酵母
http://uwb01.bml.co.jp/kensa/search/detail/3810128
