タグ: protein-purification
-
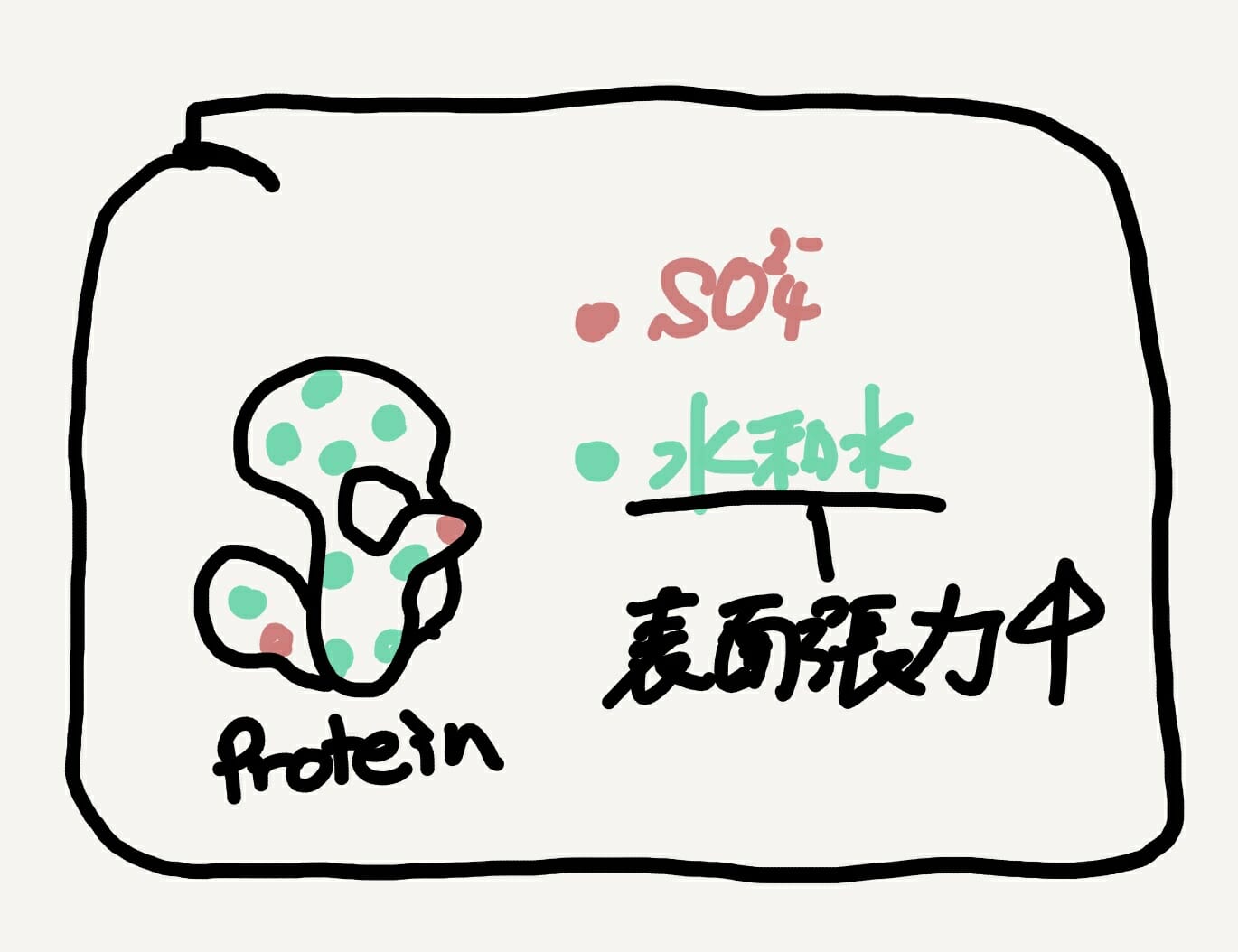
[Bio-Edu] タンパク質の「イオン交換体」による精製原理 – 目的タンパク質の物性を知る必要性 [2021/02/25]
Post Views: 794 はじめに タンパク質の精製とは、どのような作業をするのでしょうか? 精製とは目…
投稿者

-
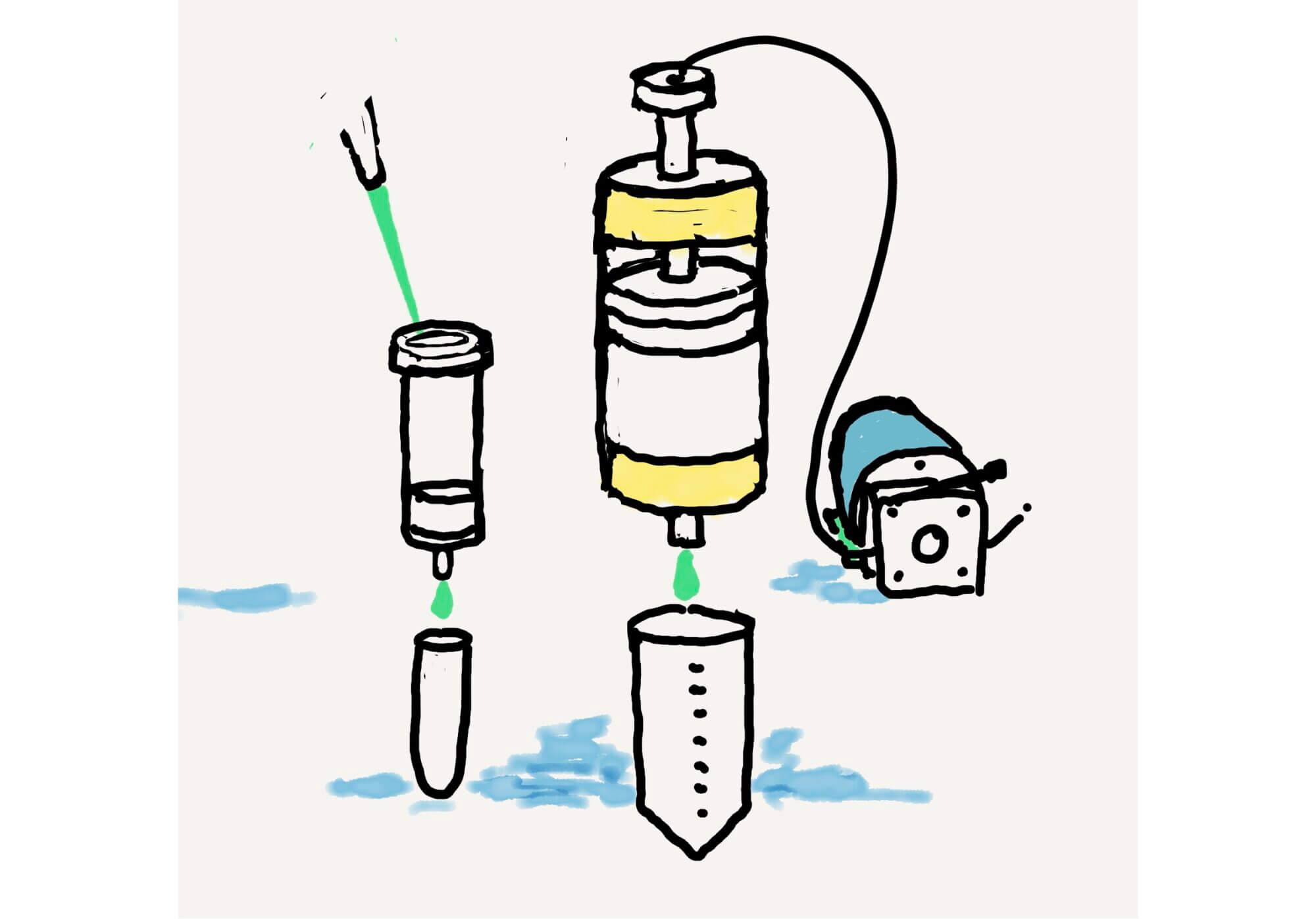
[Bio-Lab] 実験の自動化 – 小型PLCでUF/DF工程を低コストで自動化する [2020/05/25]
Post Views: 999 はじめに バイオの実験でUF/DFは、結構面倒です。メーカーからは、大袈裟な装…
投稿者

-
[Bio-Edu] 沈殿化法によるタンパク質の回収・分離 – 検討方法 – ID4376 [2025/04/21]
Post Views: 965 はじめに Ribonuclease Aのアセントン沈殿の条件検討につい、学生さ…
投稿者

-
[Bio-Edu] 細菌・ウイルスをフィルターろ過で除去する[2020/05/25]
Post Views: 1,061 はじめに バイオ医薬品の製造において、製品段階では細菌が含まれないことを保…
投稿者

-
[Bio-Lab] マニュアル式のラボスケール・カラムクロマトで蛋白質精製の条件を検討する – ID3106 [工事中]
Post Views: 486 はじめに タンパク質精製の戦略 高価な装置が無くても始められる蛋白質の精製につ…
投稿者

-
[Bio-Edu] タンパク質(蛋白質)の精製 – 基礎編 – 不純物の定義、RefoldingからUF膜精製、タンパク質精製の定石まで – そしてタンパク質を知る – ID686 △[2021/06/03]
タンパク質精製に関する温故知新、誰でもできるタンパク質の精製概要が理解できる基礎編を解説。最近のrAAV精製を…
投稿者