タグ: LONZA
-
[Vc] Moderna – COVID-19 ワクチン臨床(Phase 3の中間結果は94.5%の有効性を示した – ID19527 [2020/11/16]
Moderna社は、新型コロナウイルスのmRNAワクチンを開発している。臨床は、Phase 3を進めており、中…
投稿者

-
気になる企業 – LONZA – 遺伝子治療薬の製造も含めたバイオロジクスCDMOとして投資を進め世界の需要に応える [2021/05/29]
Post Views: 895 LONZA 動向 Lonzaの投資状況から、世界の需要は更に膨らんでいることが…
投稿者

-
気になる企業 – Moderna – 新モダリティ(mRNA)・ワクチン (新型コロナウイルス) で駆ける / Phase IIIの中間結果では94.5%の有効性を示す – LNP製剤による2~8℃保存が可能である優位性 – ID15029 [2020/12/03]
新型コロナウイルスのワクチン開発を進めている米国のバイオテクノロジー企業MODERNA社の開発の仕方から、その…
投稿者

-
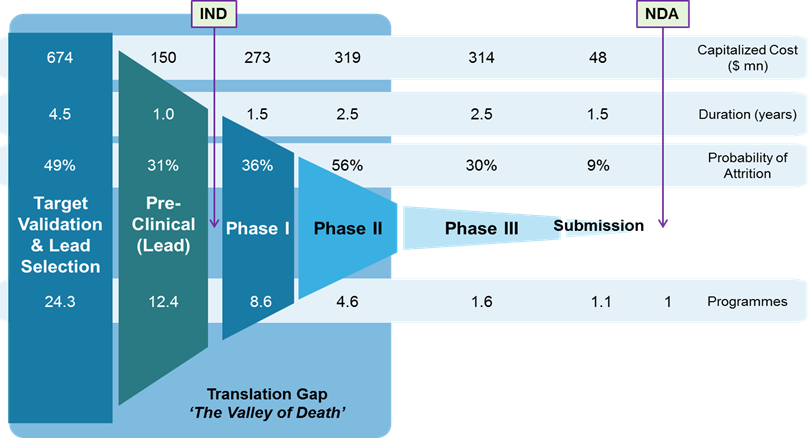
[Bio-Edu] Drug development lifecycle 医薬品の開発ステージ毎の – コスト、期間、次期移行確率 by Lonza – ID8649 [2020/02/05]
Post Views: 649 医薬品の開発 かかるコストについては、プログラム(研究テーマ)当たりで算出した…
投稿者

-
気になる企業 Cellectis – 遺伝子編集 – ID7662 [2020/01/29]
Post Views: 603 Cellectis 2011年, Cellectics社が保有する独自のメガヌ…
投稿者

-
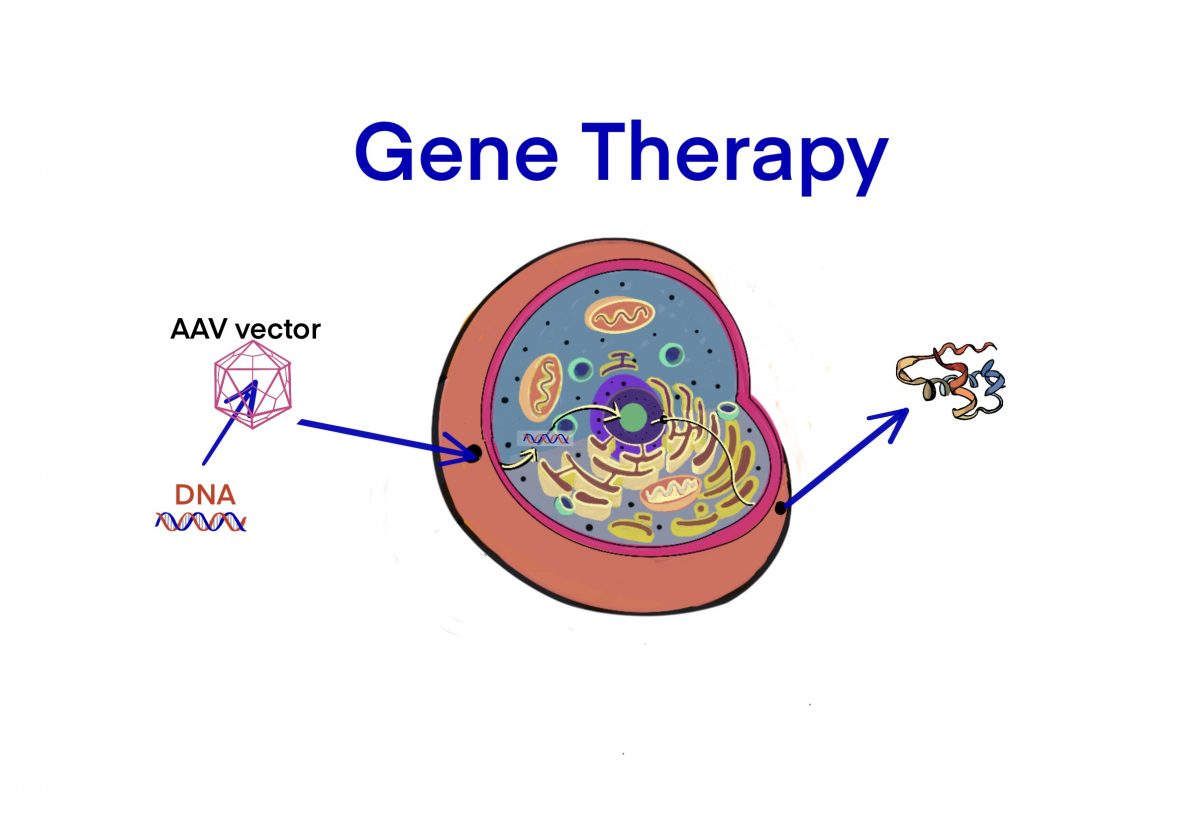
調査 – 遺伝子治療 – LONZAの動向 – ID3803 [2020/05/07]
Post Views: 475 AAV AAVは、病原性が無いとされるウイルスである。正式名はAdeno As…
投稿者

-
[Bio-rAAV] 遺伝⼦治療における代表的な委託製造会社 (CMO) – ID1881 [2021/02/08]
Post Views: 468 rAAV vectorを製造するCMOリスト 企業サイト サイト 製造サイト …
投稿者