タグ: education
-
[血液凝固因子] Fibrinogen – ID2549 [2023/10/23]
Post Views: 456 はじめに Fibrinogen (フィブリノゲン)は,巨大分子であること,タン…
投稿者

-
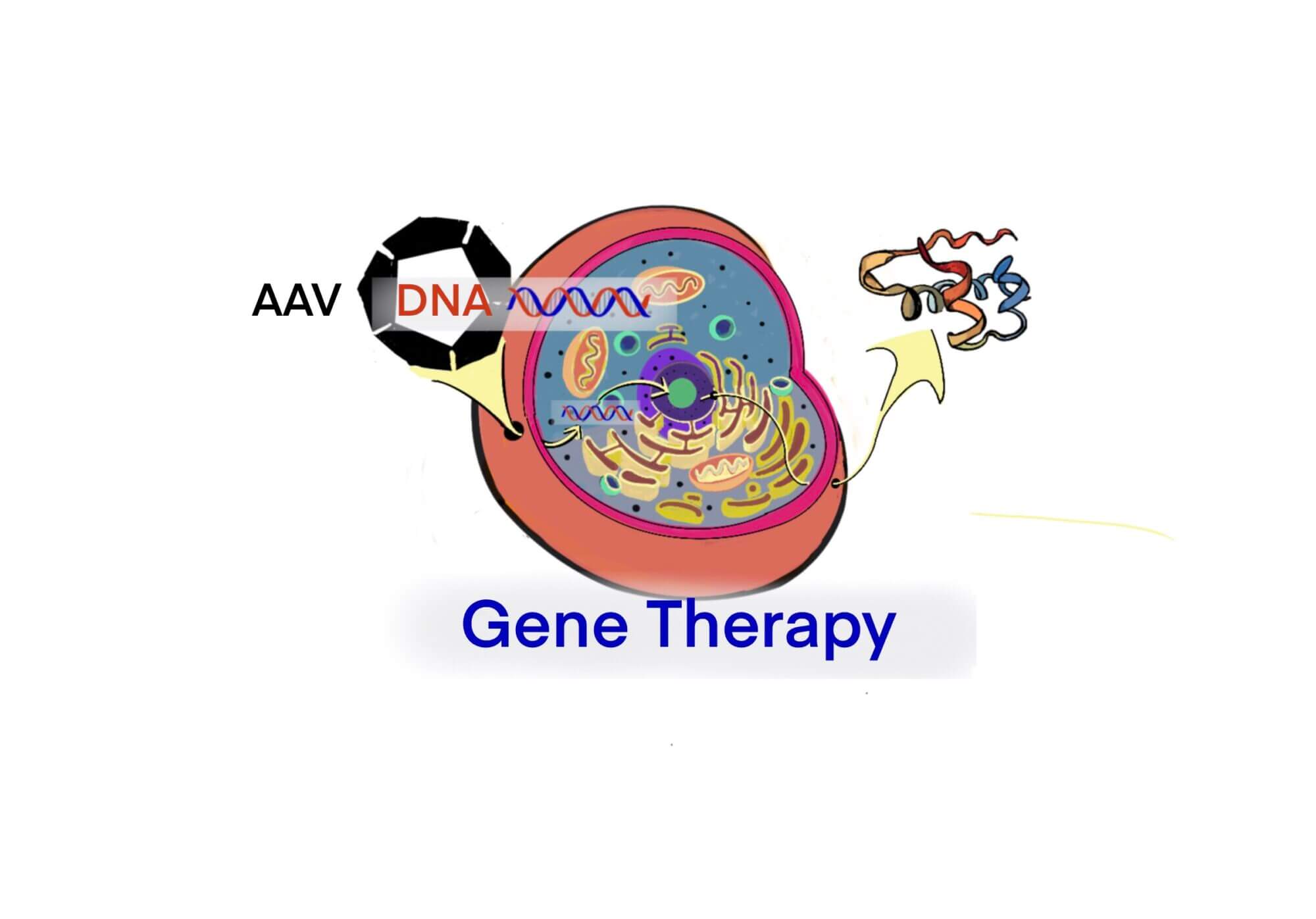
[rAAV] Parvovirusに属するアデノ随伴ウイルス(AAV)をベクター(rAAV)にして遺伝子治療を行う — rAAVの特徴と臨床 (2003) – ID2516 [2019/10/02]
Post Views: 619 AAVベクター Adeno associated virus (AAV) ベク…
投稿者

-
[rAAV] 遺伝子治療薬としての遺伝子組換えAAV(rAAV)の沈殿法による精製のいろいろ – ID2452 [2019/09/27]
Post Views: 532 はじめに 遺伝子治療薬として、ヒトの細胞に感染させ目的の遺伝子をその細胞に導入…
投稿者

-
[rAAV] rAAVの従来からの精製方法 (PEG沈殿、超遠心), 2010 – ID2417 [2019/09/26]
Post Views: 632 rAAV vectorの精製方法 沈澱化と遠心分離、および超遠心機を使用する従…
投稿者

-
[Data Link] Pharmacology of Recombinant Adeno-associated Virus Production – ID2415 [2019/09/26]
Post Views: 511 Impurities Related to the Purificaiton …
投稿者

-
[Bio-Edu] ラクダが持っている抗体は、一般的なIgGとは異なる構造の重鎖抗体 – ID2300 [2019/09/21]
Post Views: 623 ラクダの重鎖抗体 一般的にラクダ抗体は、通常の抗体IgGとは異なる構造の重鎖抗…
投稿者

-
[rAAV] rAAVベクターの精製方法 – Universal Method (2018) – ID2266 [2019/09/18]
Post Views: 506 はじめに 遺伝子治療薬のデリバリー・システムとしてAAV使用が盛んです。今後は…
投稿者

-
[Data Link] Purification of rAAV-1 and -9 with ultracentrifugation-free technique towards GMP production.(2013-2015, 科研費研究) – ID2225 [2019/09/15]
Post Views: 436 Purification of rAAV-1 and -9 with ultr…
投稿者

-
[Data Link] 遺伝子治療臨床研究実施計画書 – ヒトβ型インターフェロン発現プラスミド包埋正電荷リポソーム製剤を用いる進行期腎細胞癌の 遺伝子治療臨床研究 – □ID2223 [2019/09/15]
Post Views: 415 ヒトβ型インターフェロン発現プラスミド包埋正電荷リポソーム製剤を用いる進行期腎…
投稿者

-
[Data Link] 「遺伝子治療製品の過去・現在・未来」H27 – ID2218 [2019/09/15]
Post Views: 426 平成27年度 国立薬品食品衛生研究所シンポジウム 「新しい法律に基づくレギュラ…
投稿者