タグ: education
-
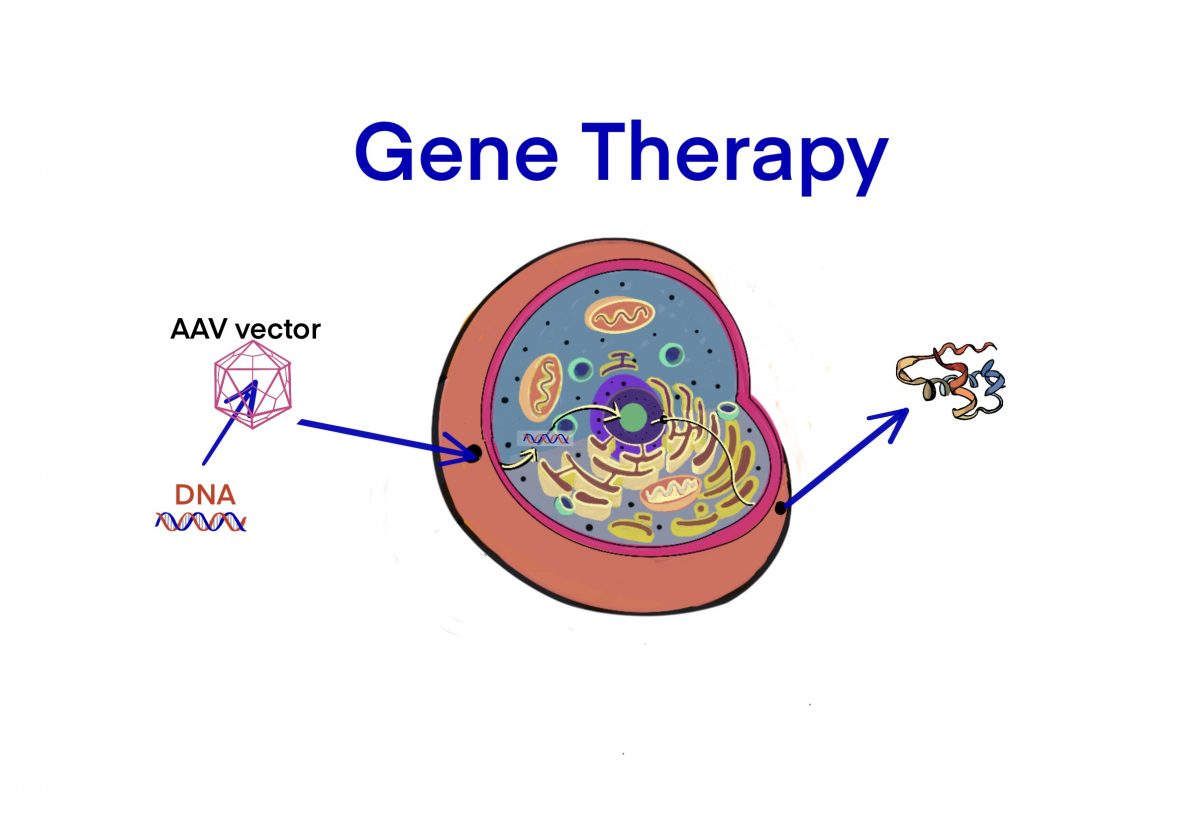
[Bio-Edu] Plasmid – バイオロジクスには欠かせない遺伝子組換え技術、そして rAAVを作るまで! – AAV Vector配列の例 [2020/08/05]
rAAVによる遺伝子治療薬の開発には、遺伝子組換え技術が使われている為、この知識がなくてはならい。 rAAVを…
投稿者

-
[Bio-Edu] CHO細胞培養プロセス – スケールアップ – 温度シフトの検討は欠かせない [2020/10/30]
Post Views: 1,164 はじめに 培養規模をスケールアップする目的は、コンスト低減化、需要対応など…
投稿者

-
[Bio-Edu] バイオ医薬品 (バイオロジクス)は、CHO細胞の技術革新と共に進展してきた [2020/08/05]
Post Views: 1,006 バイオ医薬品とは バイオ医薬品は、英語でバイオロジクスと言います。バイオロ…
投稿者

-
[Bio-Edu] Fcエフェクター活性 – ADCC活性を増強するafucosylation技術 [2020/05/22]
IgG1のFc領域は、FcγRIIIaと結合親和性があり、その結合強度によってADCC活性が増強されます。この…
投稿者

-
[Bio-Edu] バイオ医薬品におけるウイルス・クリアランス試験 – モニターウイルス – 除去率 – [2020/08/23]
Post Views: 1,055 はじめに Biologics (生物製剤)では、混入する可能性のあるウイル…
投稿者

-
[Bio-Edu] DNAワクチンとは – 2008年までの論文から、免疫細胞へのプラスミドDNAの取り込みにより特異抗体が産生される – ID13931 [2020/04/21]
Post Views: 921 DNAワクチンとは 1998年、2000年および2008年の論文から、DNAワ…
投稿者

-
[Bio-Edu] 沈殿化法によるタンパク質の回収・分離 – 検討方法 – ID4376 [2025/04/21]
Post Views: 964 はじめに Ribonuclease Aのアセントン沈殿の条件検討につい、学生さ…
投稿者

-
[Virus-Edu] WHO が、新型コロナウイルス(SARS-CoV-2)の治療薬に関する大規模臨床を開始する – ID13021 [2020/04/09]
Post Views: 796 WHOがCOVID-19治療薬の臨床を開始 4つの薬剤について大規模な臨床試験…
投稿者

-
[Bio-Edu] Surfactant – PF-68, PS80 の添加は常識 – 凝集の抑制 – ID12904 [2021/06/19]
Post Views: 1,180 界面活性剤 タンパク質の凝集抑制には、古くから界面活性剤 (surfact…
投稿者