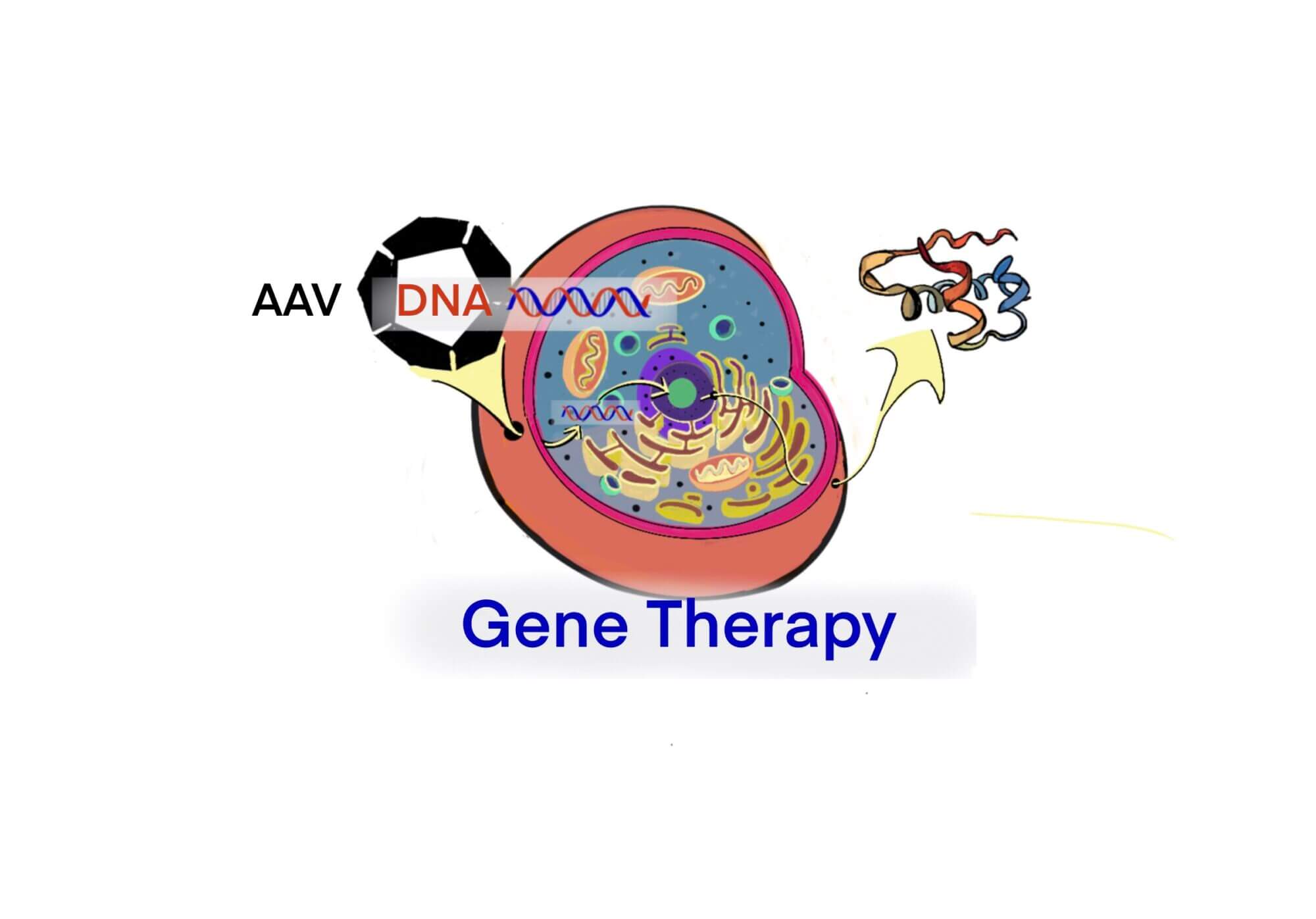
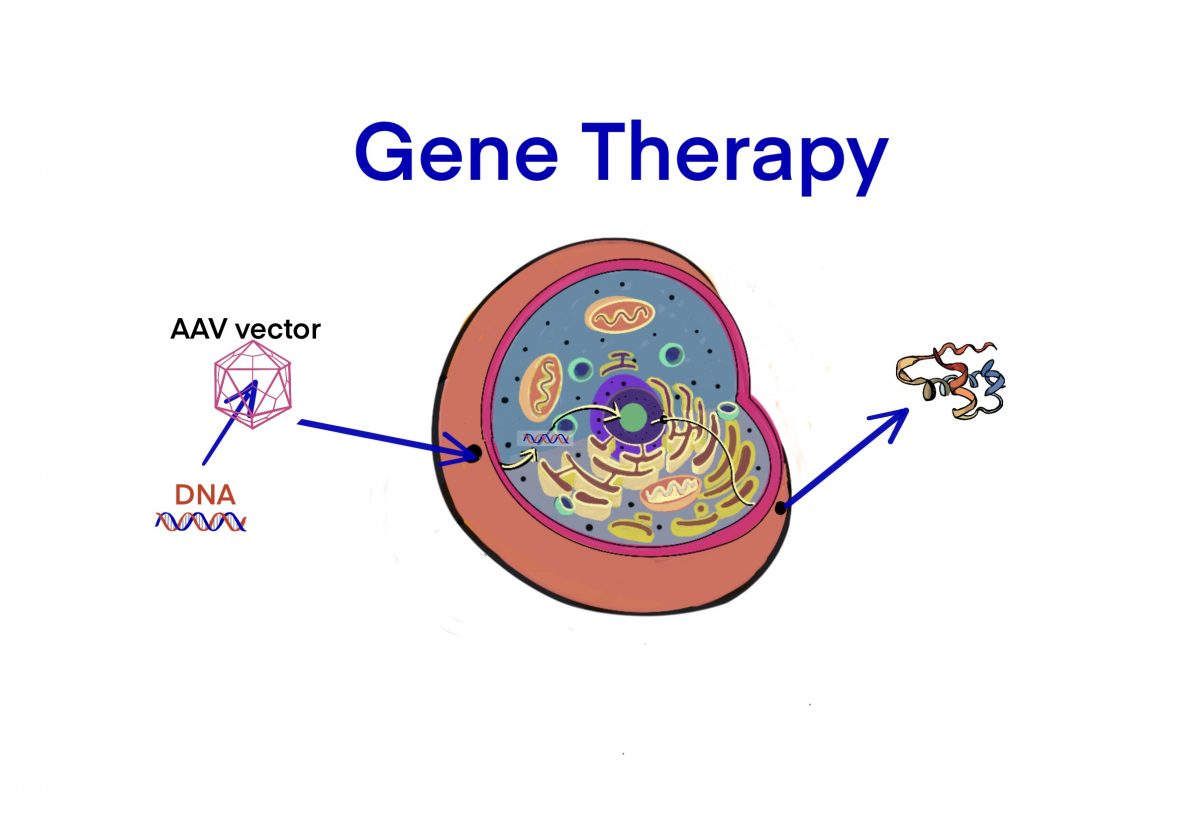
タグ: AAV
-
[Data Link] 遺伝子治療に関する規則について – ID2221 [2019/09/15]
Post Views: 418 H30 厚生労働省 https://www.kantei.go.jp/jp/s…
投稿者

-
[Data Link] 「遺伝子治療製品の過去・現在・未来」H27 – ID2218 [2019/09/15]
Post Views: 426 平成27年度 国立薬品食品衛生研究所シンポジウム 「新しい法律に基づくレギュラ…
投稿者

-
[rAAV-Edu] AAVベクターに関する「生物多様性影響評価書」の作成 – [2019/09/15]
Post Views: 419 ID2177 生物多様性影響評価書 rAAVなどを用いた遺伝子治療による治験を…
投稿者

-
[Bio-Edu] AAV およびrAAV vector について- 長所/短所、立体構造、分子量および血中半減期 及び他ベクターとの比較[2020/11/05]
Post Views: 668 はじめに 遺伝子治療用に使用されるウイルスベクターには、AAVの他にLenti…
投稿者

-
[Data Link] rAAV vector/遺伝子治療薬に関する文献調査 [~2020/08/24] – ID2033 [2019/09/13]
Post Views: 437 Key Considerations in Gene Therapy Manu…
投稿者

-
[Bio-rAAV] 遺伝⼦治療における代表的な委託製造会社 (CMO) – ID1881 [2021/02/08]
Post Views: 469 rAAV vectorを製造するCMOリスト 企業サイト サイト 製造サイト …
投稿者

-
[GT] 世界で承認された細胞・遺伝子治療薬 – ID1872 [2019/09/06]
Post Views: 339 遺伝子治療薬リスト(2017) 2017年に経済産業省がまとめた、世界で承認さ…
投稿者

-
[Bio-rAAV] アデノ随伴ウイルス(AAV)ベクターを使用する意義(特徴)と製造概要 – ID1862 [2019/09/06]
Post Views: 414 ID1862 rAAVベクターの特徴 遺伝子がランダムに導入される理由を掘り下…
投稿者