カテゴリー: BIOLOGICS
-
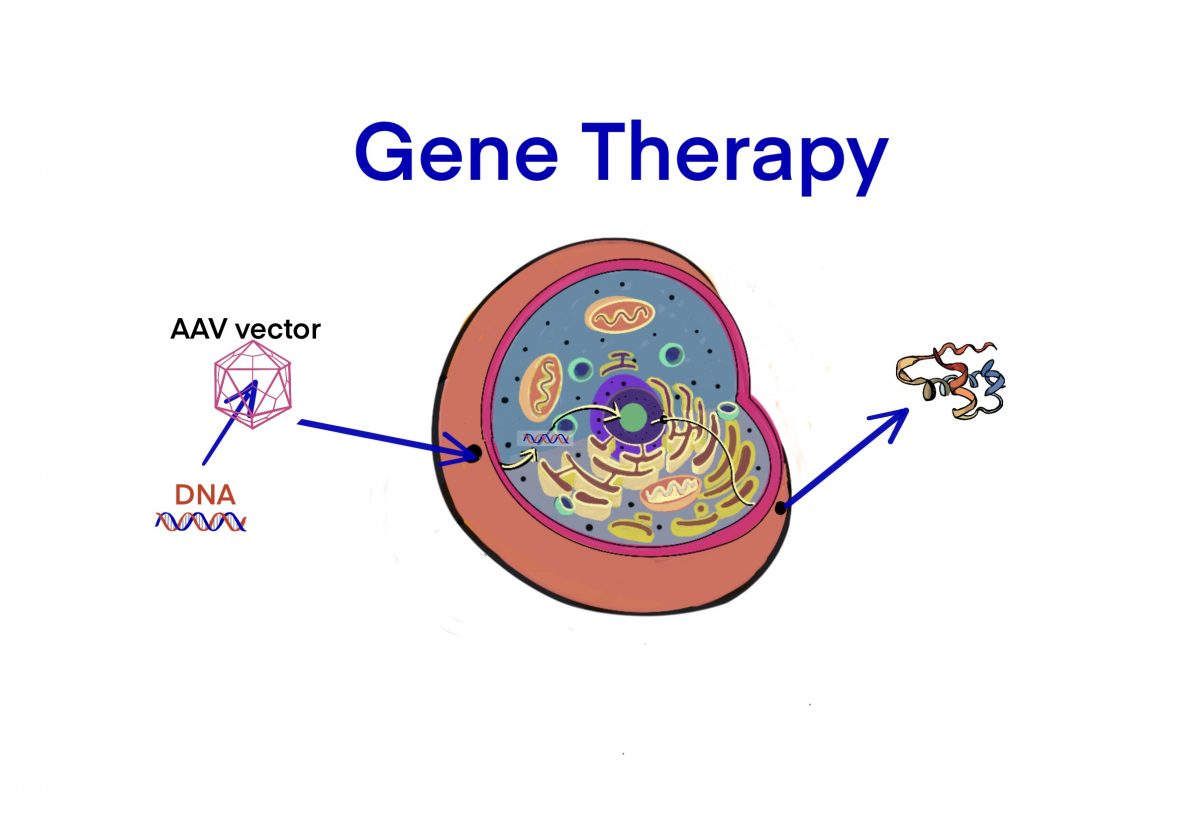
[Data Link] FDAの遺伝子治療薬への強いサポートの表明 – ID8513 [2020/01/28]
Post Views: 606 冒頭声明の和訳 FDAは、アメリカ人や世界中の人々のために新しい医療製品を開発…
投稿者

-
[Link] 遺伝子治療のFDAガイダンス – ID8495 [2020/02/03]
Post Views: 597 遺伝子治療のFDAガイダンス 希少疾患における治療薬の同一性の解釈 同一である…
投稿者

-
[Bio-Edu] 治験実施までの留意事項 – 製薬協 – ID8497 [2020/02/03]
Post Views: 601 はじめに 遺伝子治療用製品及び感染症の予防を目的とする遺伝子組換え生ワクチンの…
投稿者

-
[Bio-rAAV] AAVカプシド蛋白質VP1のpH依存的な構造変化 – エンドソーム脱出につながっているのか – ID8476 [2020/02/02]
Post Views: 621 VP1の機能 カプシド蛋白質VP1の領域のうち、pH酸性(4-6)により内部に…
投稿者

-
[Bio-AAV] AAVカプシド蛋白質のpH依存的な分解性について-論文紹介 (2012) – ID8474 [2020/02/02]
Post Views: 672 要約 (Goolge翻訳より) 高度に精製されたアデノ随伴ウイルス(AAV)キ…
投稿者

-
[Bio-Analysis] Comparability Test – バイオ医薬品における同等性/同質性 – ID8641 [2024/06/1]
Post Views: 708 はじめに Release Testとは、医薬品の製造が正常に実施され、それによ…
投稿者

-
[Bio-Process] 原薬の超低温保管 ID9640 [2020/02/02]
Post Views: 736 原薬の保管 バイオロジクス精製原薬を長期保存するには、除菌ろ過フィルターでろ過…
投稿者

-
[Bio-Process] Sterile Filtration – ID8462
Post Views: 619 Bio-Equipment 精製ステップ毎のbioburden管理 原薬の除菌…
投稿者

-
[Bio-Process] UF/DF for buffer exchange – タンパク質溶液の緩衝液組成の変更 – ID8458 [2020/02/02]
Post Views: 642 抗体 抗体の精製の場合、バッファ組成を調整しないで次工程に進むことも多い rA…
投稿者

-
[Bio-Process] Virus Reduction Filtration – ウイルス除去膜 – ID8631 [2020/02/02]
Post Views: 648 Bio-Process Virus Reduction Filtration …
投稿者