タグ: guidance
-
[用語] eCTD – 医薬品の製造承認申請 の申請書様式[2024/08/19]
Post Views: 623 医薬品の製造承認申請 ・医薬品の製造販売には、品目毎に厚生労働大臣による医薬品…
投稿者

-
[用語] RTRT; real time release testing [GMP]
Post Views: 873 RTRT; real time release testing Quality…
投稿者

-
[Bio-Edu] 無菌医薬品の製造区域の環境モニタリング (レジメ) [2020/08/20]
Post Views: 913 無菌医薬品製造区域の環境モニタリング 参考サイト: Beckman courl…
投稿者

-
[Bio-Edu] Good Manufacturing Practice (GMP) guidelines
Post Views: 546 EudraLex – Volume 4 – Annex…
投稿者

-
[Bio-Edu] 生物由来原料基準のレジメ – ID9325 [2020/07/23]
Post Views: 654 生物由来原料基準 生物由来原料基準、2020/02現在 https://www…
投稿者

-
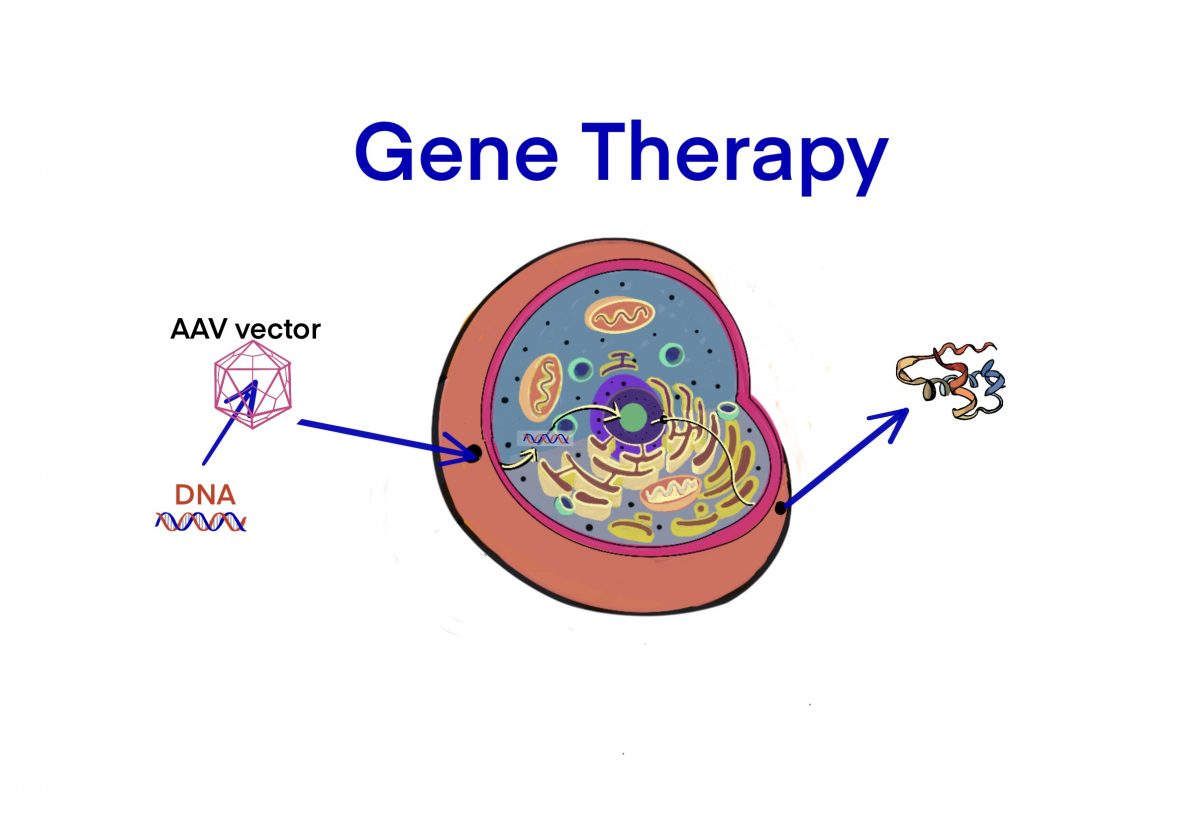
[Link] 遺伝子治療のFDAガイダンス – ID8495 [2020/02/03]
Post Views: 597 遺伝子治療のFDAガイダンス 希少疾患における治療薬の同一性の解釈 同一である…
投稿者

-
[Bio-Edu] 細胞調製施設のグレードとは (レジメ) – ID3172 [2019/12/21]
Post Views: 459 考慮事項 H25/12/24 第8回細胞組織加工製品専門部会資料 –…
投稿者

-
[Data Link] 遺伝子治療に関する規則について – ID2221 [2019/09/15]
Post Views: 416 H30 厚生労働省 https://www.kantei.go.jp/jp/s…
投稿者