タグ: education
-
[Bio-Edu] 細胞・細菌・ファージ・ウイルスを増やす 簡単な解説 – ID20721 [2020/10/06]
Post Views: 889 はじめに 初学者を対象にして、バイオを研究するために必要な知識を提供する[Bi…
投稿者

-
[Bio-Edu] 細菌・ウイルスをフィルターろ過で除去する[2020/05/25]
Post Views: 1,060 はじめに バイオ医薬品の製造において、製品段階では細菌が含まれないことを保…
投稿者

-
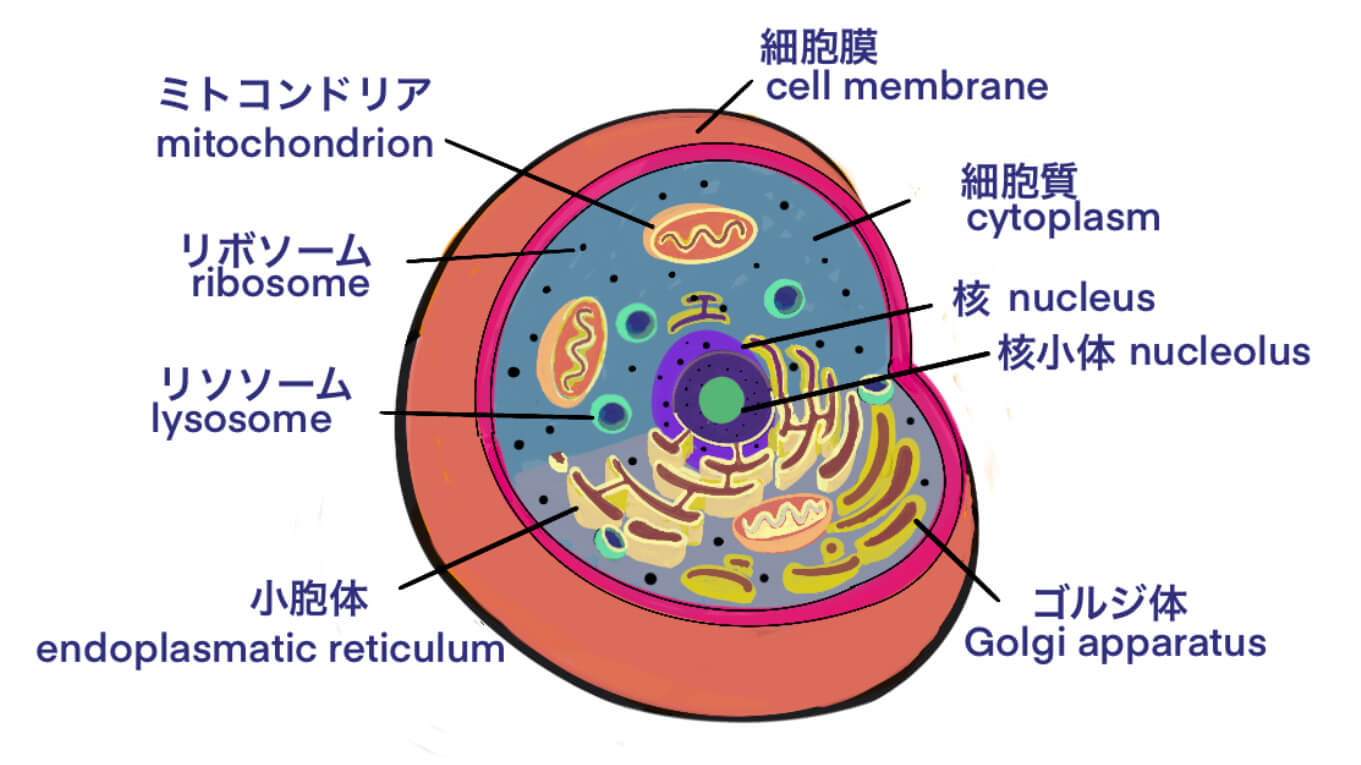
[Bio-Edu] 細胞・細菌・ファージ・マイコプラズマ・ウイルスの大きさ — ID11542 [2020/05/23]
Post Views: 719 ID11542 はじめに バイオロジクス研究を志す者として、必要となる関連知識…
投稿者

-
満を持して新世代PCR装置発売、コロナウイルスを15分で測定 – ジーンソック (GeneSoC) – キョーリン製薬 (PCR原理を含めたまとめ) – △ID10926
Post Views: 1,057 GeneSoC GeneSoc 遺伝子検査定量装置 GeneSocは、キョ…
投稿者

-
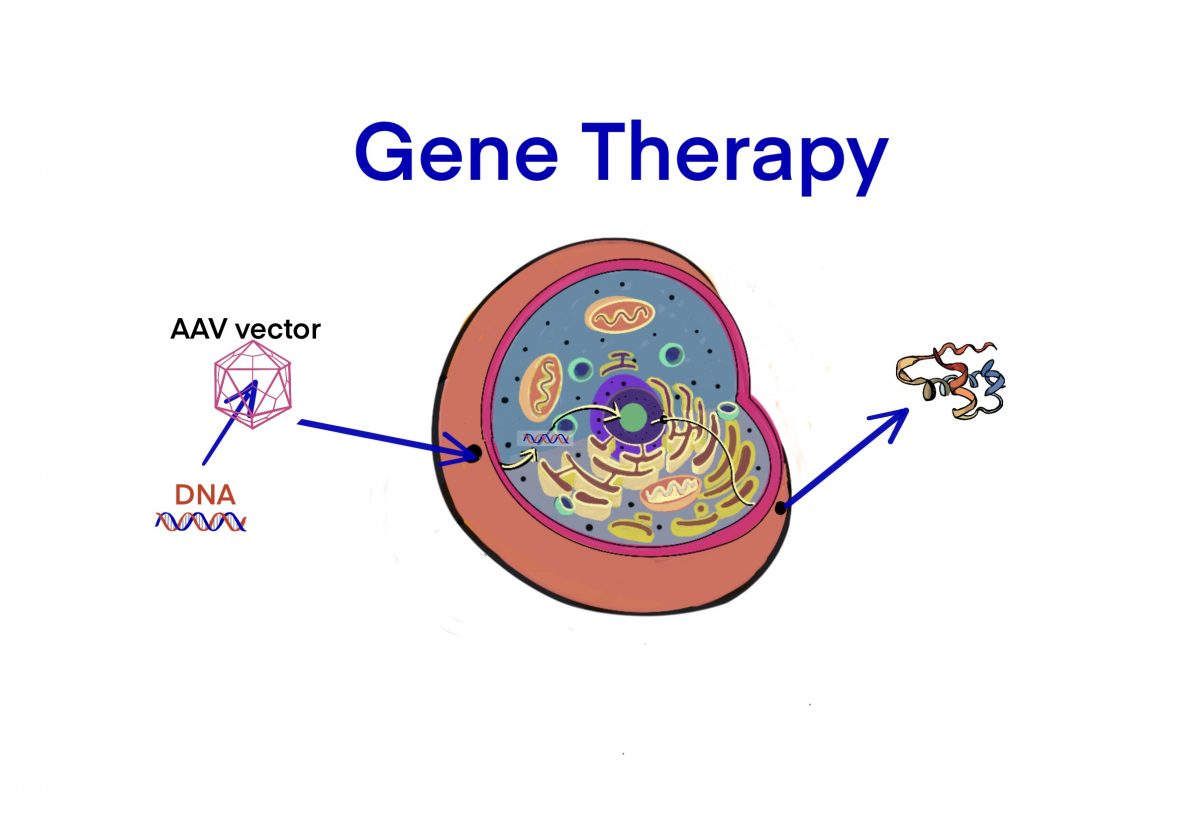
[ゲノム編集] デュアルAAVデリバリーシステムによるマウスのデュシェンヌ型筋ジストロフィーの治療研究 (CRISPR-Cas9を補助する) – ID9877 [2020/08/22]
ジュジェンヌ型筋ジストロフィーの治療薬の研究として、AAVを活用したゲノム編集型遺伝子治療研究の文献を概説し、…
投稿者

-
[rAAV-Material] AAVpro® Helper Free System – ID9843 [2020/02/19]
Post Views: 715 研究用試薬である。生じたいかなる損害に対して責任を負わない。ライセンス締結は、…
投稿者

-
[Bio-Edu] 各種RNAの生物学的な作用点のマップ – by Qiagen – ID9331 [2020/02/13]
Post Views: 654 各種RNAの作用 以下、Qiagenのサイトには、細胞内における各種RNAの作…
投稿者

-
[Bio-Material] バイオロジクス・3Mの清澄ろ過膜 – Zeta Plus – □ID9266 [2020/02/12]
Post Views: 665 https://www.3mcompany.jp/3M/ja_JP/compa…
投稿者

-
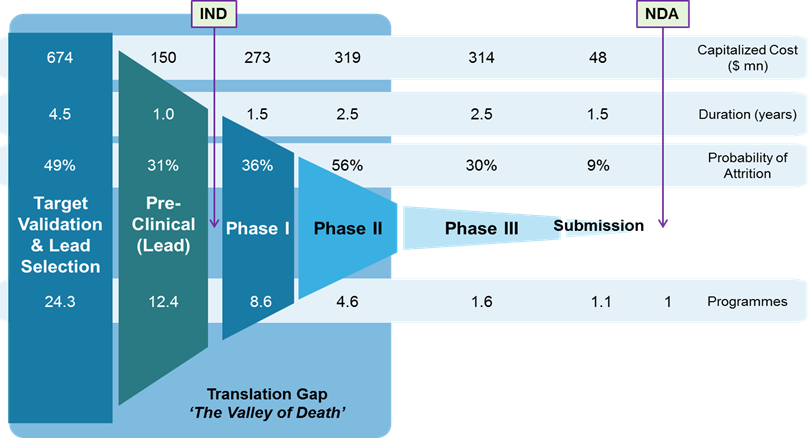
[Bio-Edu] Drug development lifecycle 医薬品の開発ステージ毎の – コスト、期間、次期移行確率 by Lonza – ID8649 [2020/02/05]
Post Views: 649 医薬品の開発 かかるコストについては、プログラム(研究テーマ)当たりで算出した…
投稿者