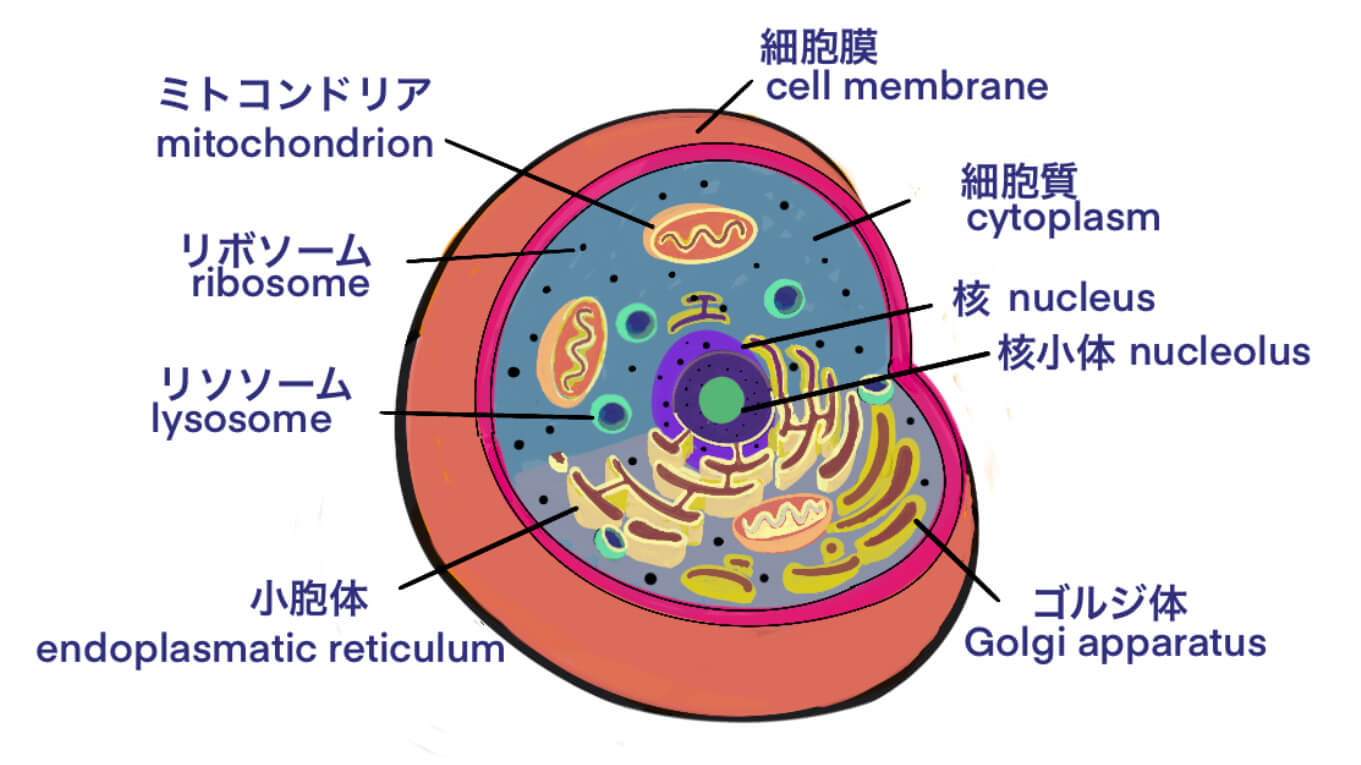
タグ: cell
-
[用語] PCL – Packaging Cell Line/Producer Cell Line [2020/08/23]
Post Views: 963 Producer Cell LineとPackaging Cell Lineの…
投稿者

-
[Bio-Edu] バイオ医薬品 (バイオロジクス)は、CHO細胞の技術革新と共に進展してきた [2020/08/05]
Post Views: 1,003 バイオ医薬品とは バイオ医薬品は、英語でバイオロジクスと言います。バイオロ…
投稿者

-
[Bio] 細胞の同一性試験 – DNA Finger Printing Test (Random amplified polymorphic DNA; RAPD) – ID12852 [2020/03/31]
Post Views: 769 細胞の同一性 アイソエンザイム解析 細胞株の同一性試験としては、規制当局の要件…
投稿者

-
[Bio-Edu] 細胞・細菌・ファージ・ウイルスを増やす 簡単な解説 – ID20721 [2020/10/06]
Post Views: 889 はじめに 初学者を対象にして、バイオを研究するために必要な知識を提供する[Bi…
投稿者

-
[Bio-Edu] 細胞・細菌・ファージ・マイコプラズマ・ウイルスの大きさ — ID11542 [2020/05/23]
Post Views: 718 ID11542 はじめに バイオロジクス研究を志す者として、必要となる関連知識…
投稿者

-
[Bio-Process] 細胞バンク – ID9833 [2020/02/01]
Post Views: 688 生産細胞株 通常、Cell Bankの保管は、劣化を極力抑えるために液体窒素蒸…
投稿者

-
[用語] HEK細胞 ; ヘックさいぼう – バイオ医薬品で用いられる生産用宿主細胞
Post Views: 600 HEK 細胞 ; human embryonic kidney cell 詳し…
投稿者

-
[用語] codon ; コドン – 遺伝子の構成要素はA,T,G,C、アミノ酸は3つの組み合わせ
Post Views: 609 codon コドン(英: codon)とは、核酸の塩基配列が、タンパ…
投稿者

-
[Bio-Edu] バイオ医薬品における生産細胞株の構築の方法 – ID5029 △[2020/08/19]
Post Views: 740 細胞株の構築 最近のバイオ医薬品の生産細胞株構築フローを以下に示します。 Ho…
投稿者