Post Views: 865
はじめに
バイオ医薬品の製造において、製品段階では細菌が含まれないことを保証する必要があります。
ウイルスにおいても、どれくらいの確率で含まれないかを証明する根拠となる予備データと、その確率を保証できる条件でろ過したことを保証する必要があります。
ウイルスに関しては、少々コストを要することになります
細菌のろ過による除去
バイオ医薬品は蛋白質です。細菌との大きさの違いを利用して、フィルターによるろ過により細菌をフィルターに捕捉して除去します。
- 細菌を除去する工程の実施
- 細菌が含まれないことを示すテストの実施
細菌をタンパク液から除去するには、0.22μmのフィルターを使用します。
- 大きい
- 細菌(5μm)
- フィルターろ過 (サイズ: 0.22μm)
- タンパク質 (~10nm)
- 小さい
ウイルスのろ過による除去
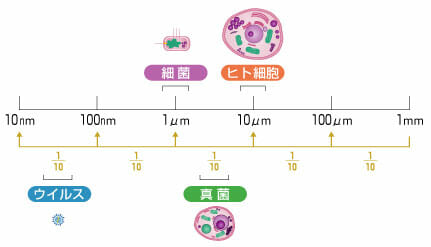
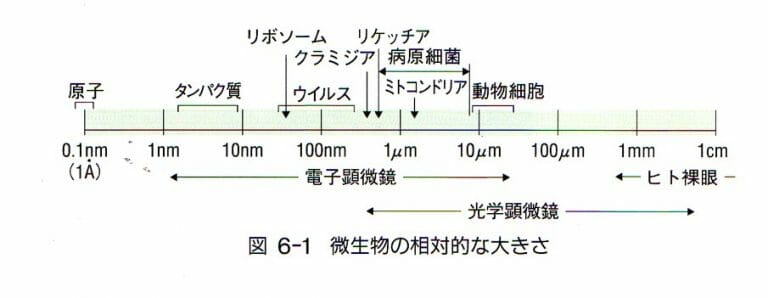
ウイルスの除去については、細菌の除去のようには、簡単ではありません。理論的には、ウイルスは1個であれば感染すると考えられます。ウイルスの測定も簡単ではありません。ウイルス除去は、ウイルス・クリアランス試験という項目があり、詳しい説明はそちらに任せます。
簡単な説明は、以下の通りです。
バイオ医薬品の世界では、ウイルス除去フィルターが市販されています。公称としては、20nm, 30nmなどの孔径(ポアサイズ)がありますが、バッファー条件、温度、ろ過速度なでど、ウイルスの運動・形状などか変化するため、除去効率は変化してしまいます。
- 大きい
- 細菌(5μm)
- フィルターろ過 (サイズ: 0.22μm)
- ウイルス (20nm~100nm)
- ウイルス除去フィルター(20nm, 30nm, etc)
- タンパク質 (~10nm)
- 小さい
まとめ
細菌もウイルスもろ過による除去方法は、基本的にその大きさを利用しています。ただし、ウイルスの場合は、その大きさが、細菌と比べて相当小さく、タンパク質に近いため、サイズによる分別除去は簡単ではありません。ウイルスを除去するためには、フィルターのポアサイズを厳密にコントロールできる高度な製造方法を要するためです。
バイオロジクスにおけるウイルスの除去に関しては、ウイルス・クリアランス試験という項目が設定されています。ちらもご参照ください。
編集履歴
2020/03/07 はりきり(Mr)
2020/05/25 追記(ウイルス濾過)
以上
Post Views: 856 はじめに Biologics (生物製剤)では、混入する可能性のあるウイルスについてリダクション能力を評価していることが必要であり、商用製品では、製造工程のウイルス・クリアランス試験が必須…
Post Views: 865 はじめに バイオ医薬品の製造において、製品段階では細菌が含まれないことを保証する必要があります。 ウイルスにおいても、どれくらいの確率で含まれないかを証明する根拠となる予備データと、その確…
![[WordPress] Adminimize プラグイン — ログイン・ユーザー毎に表示するメニュー項目を選択的に非表示にできる](https://harikiri.diskstation.me/myblog/wp-content/uploads/2020/03/842D723D-7AF3-46CE-AC0B-CA41A7C83033.jpeg)
![[WordPress] WordPress Share Buttons プラグイン – AddThis](https://harikiri.diskstation.me/myblog/wp-content/uploads/2020/03/345CFBB2-9DB4-4374-98DC-5895E344EBC7.jpeg)
![[用語] MFI ; Mobile Fast Index –](https://harikiri.diskstation.me/myblog/wp-content/uploads/2020/04/50403177-D5C3-411B-B8D7-8150030AD20D.png)
![[用語] AMP ; Accelerated Mobile Pages](https://harikiri.diskstation.me/myblog/wp-content/uploads/2021/04/1D3DD662-8755-453F-BB35-D35DDF461F9C.jpeg)
![Google、1年以内には全サイトにモバイルファーストインデックスを適用 — ID11575 [2020/03/07]](https://harikiri.diskstation.me/myblog/wp-content/uploads/2020/03/86C6D6B2-AF94-43D0-8F69-6C73530EAACB.jpg)
![[Bio-Edu] 細菌・ウイルスをフィルターろ過で除去する[2020/05/25]](https://harikiri.diskstation.me/myblog/wp-content/uploads/2021/02/80F3D755-3019-49C6-BDAE-47D137C87826.jpeg)


![[Bio-Edu] 細胞・細菌・ファージ・マイコプラズマ・ウイルスの大きさ — ID11542 [2020/05/23]](https://harikiri.diskstation.me/myblog/wp-content/uploads/2020/09/0E1A8FDA-ABDA-4D42-811D-BE0041CBB6CB.jpeg)

![[WordPress] サイトのスピードを測る – EZOIC](https://harikiri.diskstation.me/myblog/wp-content/uploads/2021/05/636BEFBC-B32D-43DA-82DE-670E9BF37E8A.jpg)




![[BIo-Equip] ACQUITY UPLC H-Class PLUS Bio – Waters – 分析用液体クロマトシステム – ID11528 [2020/03/06]](https://harikiri.diskstation.me/myblog/wp-content/uploads/2020/03/E738F27E-152B-4177-B380-AE018E4F8B8E.jpeg)




![[Bio-Equip] Imaged cIEF and CE-SDS – proteinsimple – ID11524 [2020/03/06]](https://harikiri.diskstation.me/myblog/wp-content/uploads/2020/03/C62B1105-A934-4FD6-9E62-A52FE2689E77.png)