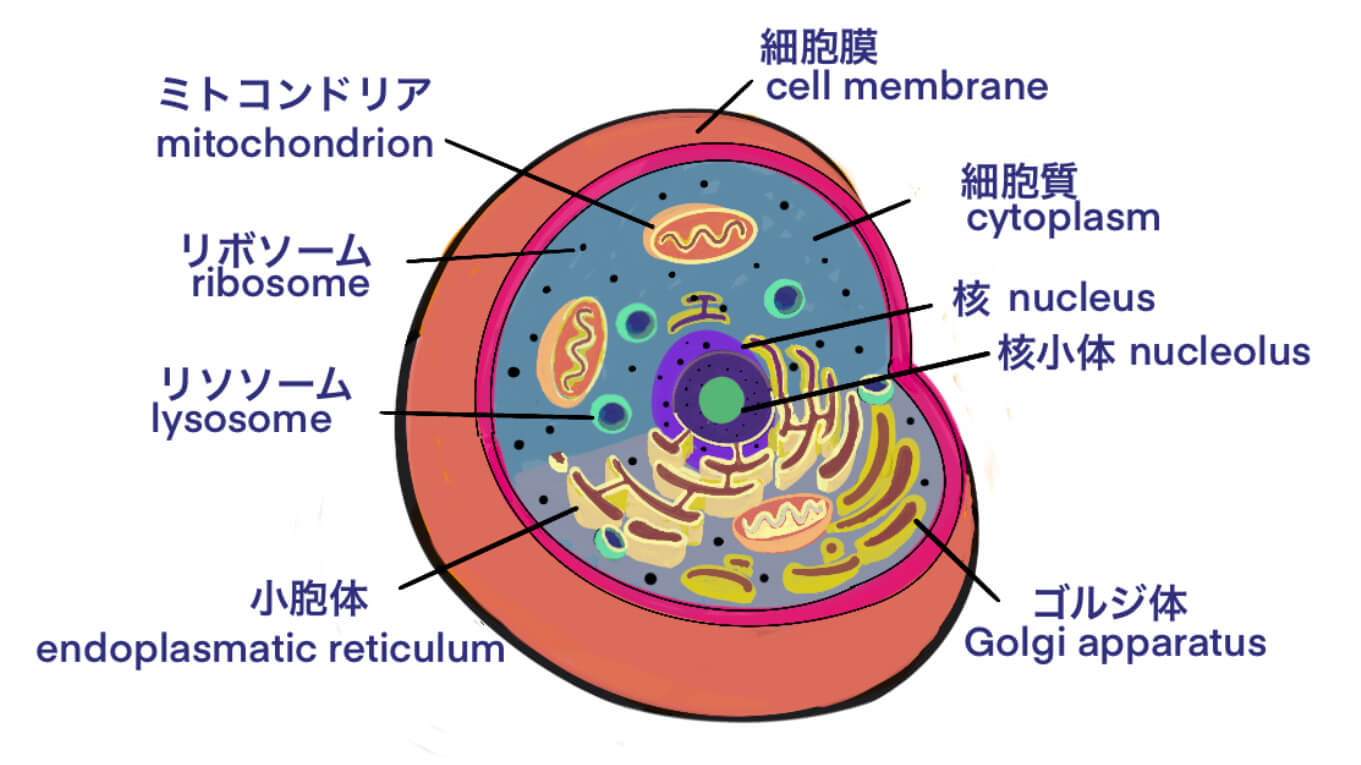
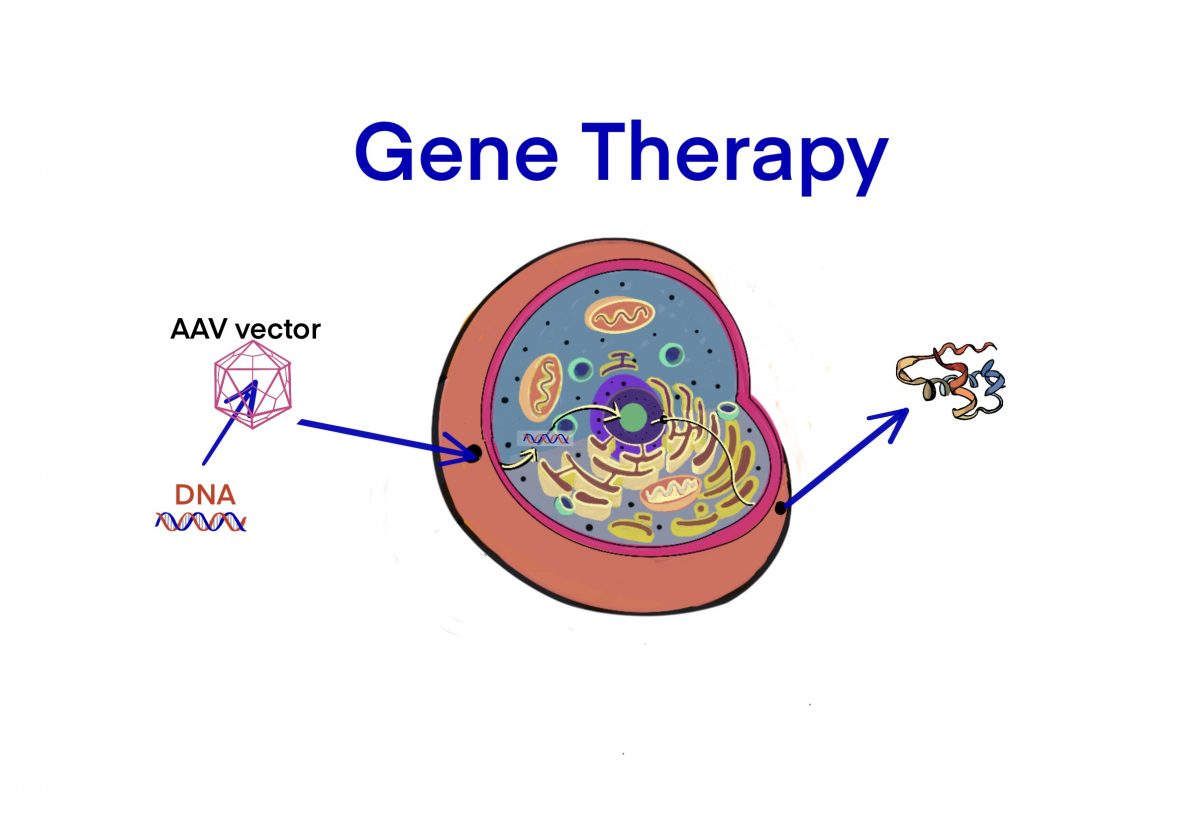
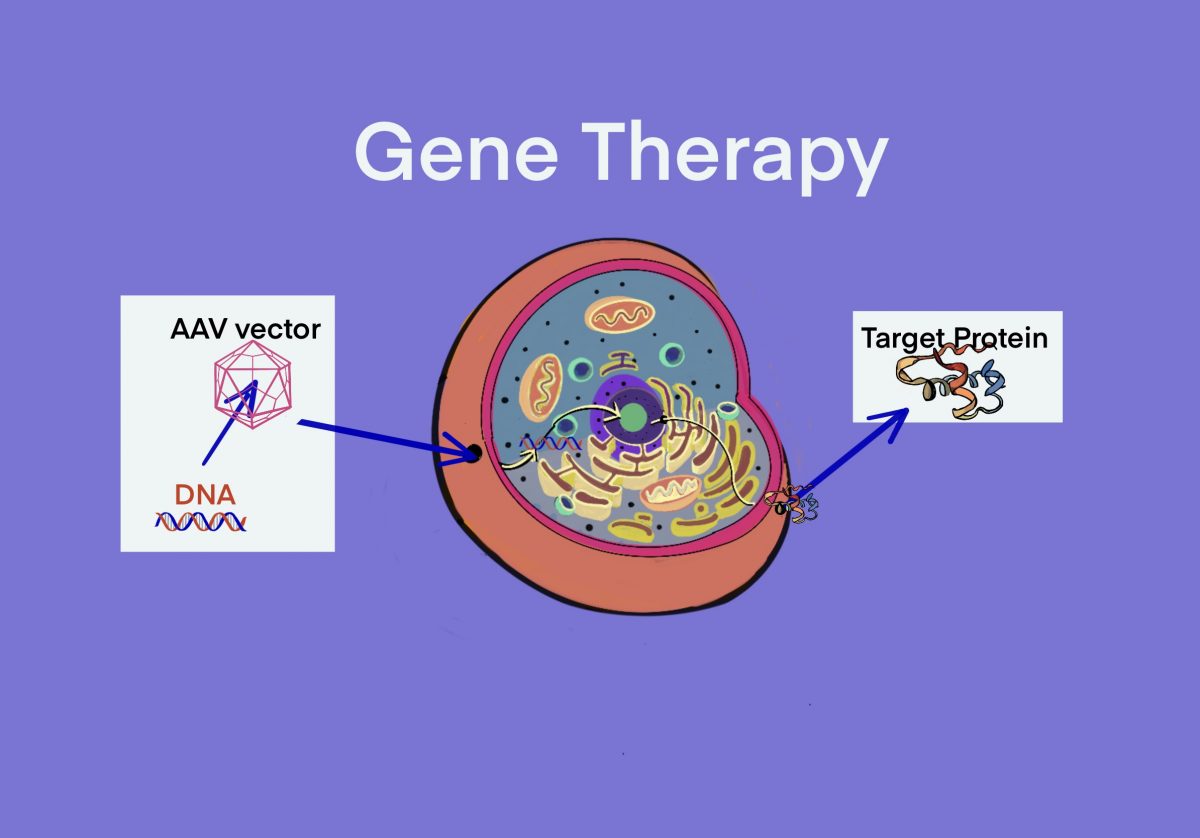
タグ: Vector
-
[Vc] アデノウイルス・ベクター・ワクチンとは – 新型コロナウイルスのワクチン開発で威力を発揮する – 必要な遺伝子のみを残す試行錯誤で、現在は第三世代 [2021/02/26]
アデノウイルス・ベクターにいて、複数の文献を網羅的にレビューした英語の文献を基に、アデノウイルス・ベクターは、…
投稿者

-
[Bio-Edu] AAV血清型別の組織別の感染親和性 – 感染とインテグレーション [2023/10/31]
Post Views: 922 AAVの感染とは AAVのウイルス粒子表面を覆っているカプシドタンパク質の構造…
投稿者

-
[Bio-Edu] Plasmid – バイオロジクスには欠かせない遺伝子組換え技術、そして rAAVを作るまで! – AAV Vector配列の例 [2020/08/05]
rAAVによる遺伝子治療薬の開発には、遺伝子組換え技術が使われている為、この知識がなくてはならい。 rAAVを…
投稿者

-
[Bio-Edu] ウイルスベクターの比較 – AAV – Adenovirus – Lentivirus – by Vigene Biosciences社 [2020/6/15]
Post Views: 870 Vigene Biosciences Vigene Biosciencesは、…
投稿者

-
[Vc] 核酸ワクチンとは DNAワクチンとmRNAワクチン – ベクターワクチンとの違い – ID15040 [2020/09/10]
Post Views: 995 ID15040 核酸ワクチン ワクチンの目的は、病原性の抑制に直接的/間接的に…
投稿者

-
気になる企業 – SIRION BIOTECH – ID12564 [2020/07/06]
Post Views: 732 ID12564 SIRION BIOTECH GmbH Office Fina…
投稿者

-
[rAAV-Material] AAVpro® Helper Free System – ID9843 [2020/02/19]
Post Views: 714 研究用試薬である。生じたいかなる損害に対して責任を負わない。ライセンス締結は、…
投稿者

-
[遺伝子治療] アデノ随伴ウイルス(AAV)ベクターによる遺伝子治療薬 – 学者の承認済み/間近/臨床試験中 – ID1124 [2020/07/17]
Post Views: 445 AAVベクターによる遺伝子治療 2020/7現在、承認及び間近の品目 Zolg…
投稿者

-
[Data Link] AAVベクター関連特許 – ID4163 [2019/12/09]
Post Views: 505 公開特許公報(A)_組換えAAV生産の効率を上昇させる方法 (2008) 神経…
投稿者

-
[Data Link] ウイルスベクターによる遺伝子導入と発現(4) – ID4158 [2019/12/09]
Post Views: 504 3.遺伝子導入と発現シリーズ ウイルスベクターによる遺伝子導入と発現(4)、三…
投稿者