タグ: vaccine
-
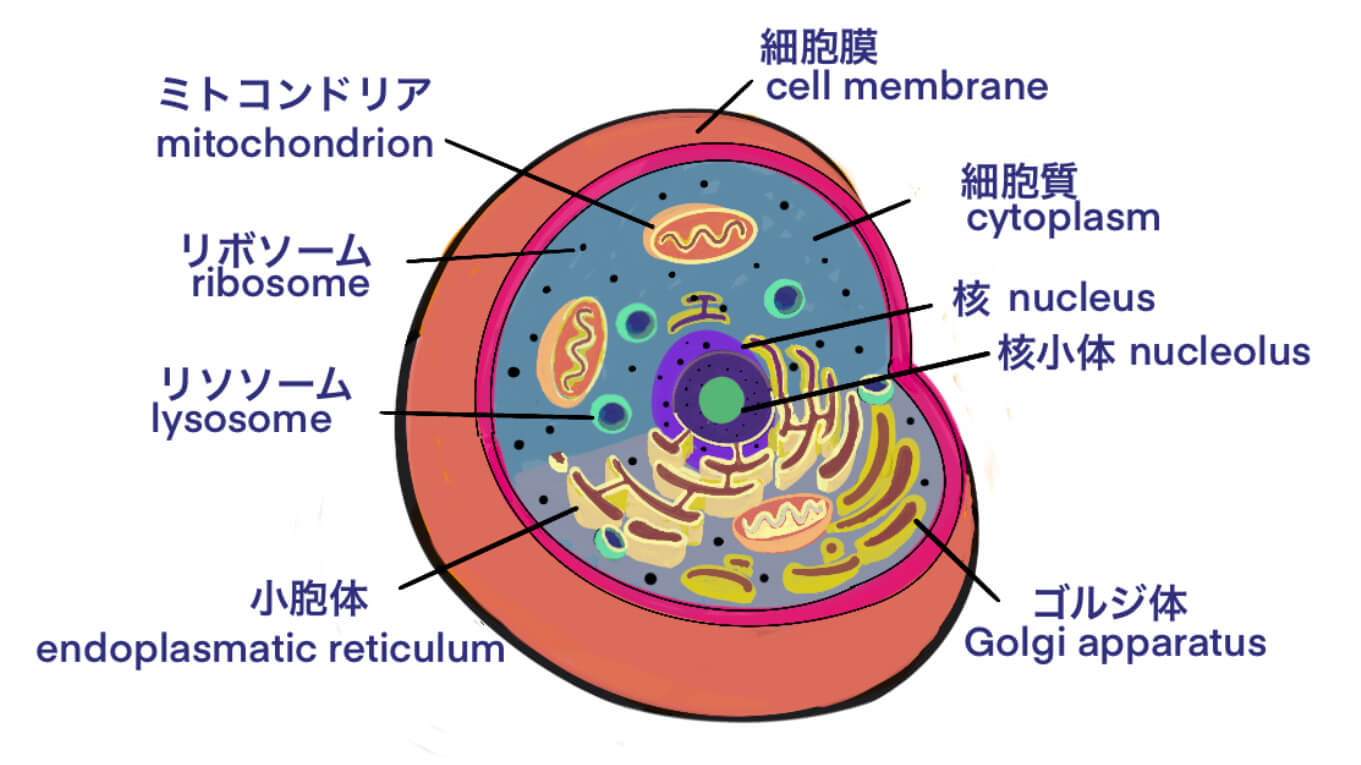
[Vc] 核酸ワクチンとは DNAワクチンとmRNAワクチン – ベクターワクチンとの違い – ID15040 [2020/09/10]
Post Views: 995 ID15040 核酸ワクチン ワクチンの目的は、病原性の抑制に直接的/間接的に…
投稿者

-
気になる企業 – Moderna – 新モダリティ(mRNA)・ワクチン (新型コロナウイルス) で駆ける / Phase IIIの中間結果では94.5%の有効性を示す – LNP製剤による2~8℃保存が可能である優位性 – ID15029 [2020/12/03]
新型コロナウイルスのワクチン開発を進めている米国のバイオテクノロジー企業MODERNA社の開発の仕方から、その…
投稿者

-
[Bio-Edu] DNAワクチンとは – 2008年までの論文から、免疫細胞へのプラスミドDNAの取り込みにより特異抗体が産生される – ID13931 [2020/04/21]
Post Views: 920 DNAワクチンとは 1998年、2000年および2008年の論文から、DNAワ…
投稿者

-
[医薬品] デング熱ワクチン「Dengvaxia」- ID3127 [2019/11/11]
Post Views: 440 Dengvaxia Sano first Pasteur社のデング熱ワクチンD…
投稿者