タグ: mRNA
messenger RNAのこと
-
[Vc] mRNAワクチンの優位性 (Morderna社) – 従来ワクチンとの比較 – ID15083 [2020/05/03]
Post Views: 857 mRNAワクチンの優位性 最初に、核酸ワクチンと従来ワクチンとの比較で、核酸ワ…
投稿者

-
[Vc] 核酸ワクチンとは DNAワクチンとmRNAワクチン – ベクターワクチンとの違い – ID15040 [2020/09/10]
Post Views: 995 ID15040 核酸ワクチン ワクチンの目的は、病原性の抑制に直接的/間接的に…
投稿者

-
気になる企業 – Moderna – 新モダリティ(mRNA)・ワクチン (新型コロナウイルス) で駆ける / Phase IIIの中間結果では94.5%の有効性を示す – LNP製剤による2~8℃保存が可能である優位性 – ID15029 [2020/12/03]
新型コロナウイルスのワクチン開発を進めている米国のバイオテクノロジー企業MODERNA社の開発の仕方から、その…
投稿者

-
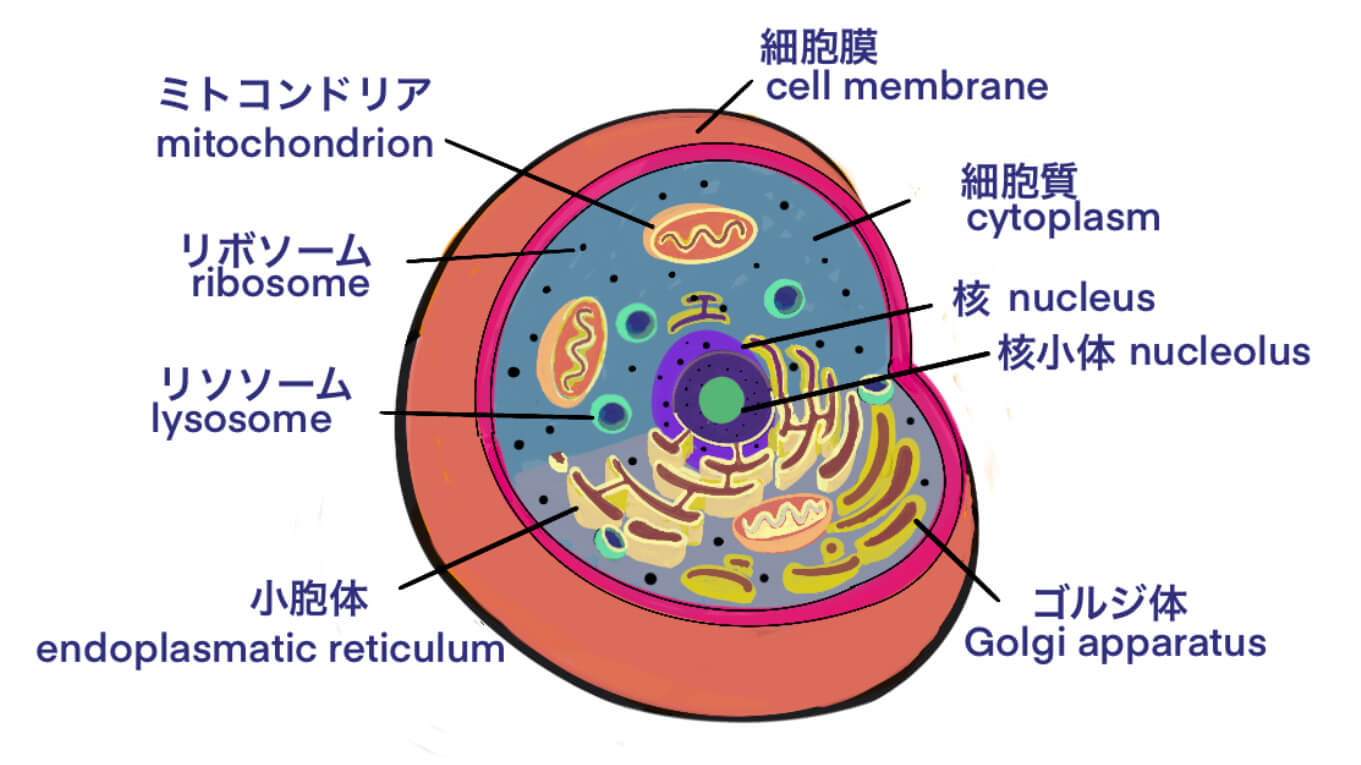
[Bio-Edu] 各種RNAの生物学的な作用点のマップ – by Qiagen – ID9331 [2020/02/13]
Post Views: 654 各種RNAの作用 以下、Qiagenのサイトには、細胞内における各種RNAの作…
投稿者

-
[Bio-Edu] RNA とは – mRNAはタンパク質を作る直接的な設計図 – その他 rRNA, tRNA – ID7254 [2020/01/15]
Post Views: 592 主なRNAは3種類 mRNA: messenger RNA rRNA: rib…
投稿者

-
[Bio-Edu] 遺伝子 – 生体内におけるDNAからタンパク質の合成 ・基礎知識 – [2020/06/13]
Post Views: 624 ID2216 遺伝子 遺伝子組換え技術を知るには、遺伝子の知識が必要だ。基礎知…
投稿者

-
[健康] 神経疾患(ミオパシー、てんかん)に共通する異常なリピート配列の発見 – リピート配列は開始コドンがなくてもたんぱく翻訳される – ID1093 [2020/07/11]
Post Views: 371 はじめに 2019/07, 東大、3つの神経筋疾患に共通する異常なリピート配列…
投稿者