カテゴリー: BIOLOGICS
-
[Bio-Equip] キャピラリー電気泳動システム – PA 800 Plus – SDS-PAGEおよびIEX分析
Post Views: 952 CESI 8000 Plus 抗体医薬を製造して品質を分析しますが、その分析項…
投稿者

-
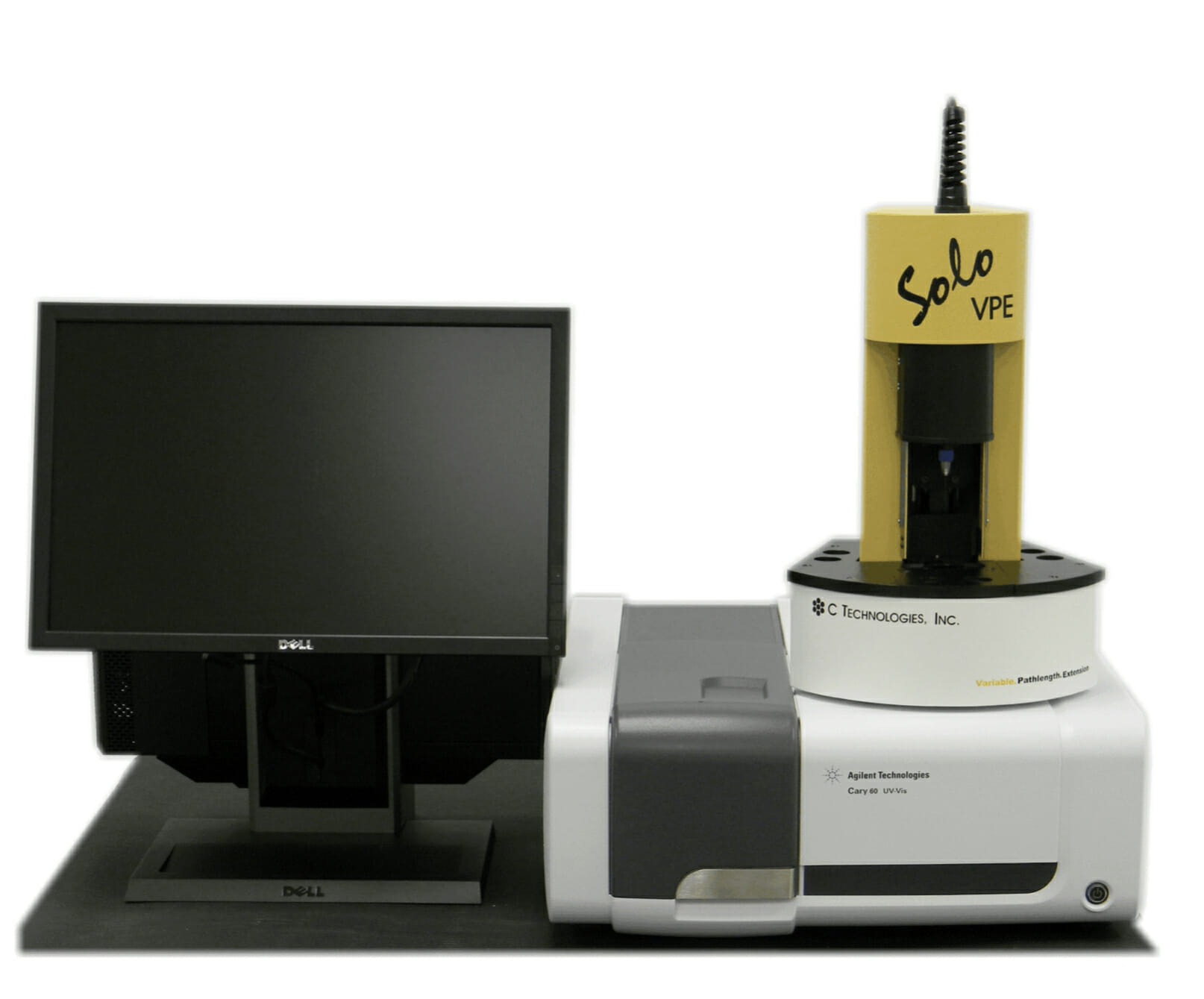
[Bio-Equip] SoloVPE – 高濃度タンパク質の無希釈測定 – GMP対応
Post Views: 997 SoloVPE 抗体医薬品のタンパク質濃度は、患者利便性から静注から皮下注に移…
投稿者

-
[バイオ関連装置] ClonePix 2 自動動物細胞コロニーピッキングシステム [2020/06/03]
Post Views: 904 ClonePix バイオロジクスの開発には欠かせない装置です。遺伝子をホストセ…
投稿者

-
[Bio-Lab] Albumin – Bovine Serum Albumin (BSA) [2020/06/03]
Post Views: 874 ラボ製品-標識試薬 精製したタンパク質分析のコントロール、例えば、タンパク質濃…
投稿者

-
[Bio-Lab] CHAPS – 膜タンパク質可溶化剤 [2020/06/03]
Post Views: 937 ラボ製品-標識試薬 精製したタンパク質の可溶性を維持したい場合に、後の除去も容…
投稿者

-
[Bio-Lab] Alexa Fluor® 488 色素 [2020/06/03]
Post Views: 869 ラボ製品-標識試薬 Alexa Fluorはタンパク質に傾向標識する試薬キット…
投稿者

-
[Bio-Lab] グラスファイバーフィルター 接着剤使用, AP20, 55 mm [2020/06/03]
Post Views: 871 ラボ製品-グラスフィルター メンブランタイプの濾過器よりも目詰まりが起こりにく…
投稿者

-
[Bio-Lab] QPix400 Imager 全自動微生物コロニーピッキングシステム [2020/06/03]
Post Views: 906 QPix400 複数枚の培養プレートに対応し多検体処理が可能。 サイトの説明か…
投稿者

-
気になる企業 – Boehringer Ingelheim – バイオロジクスの製造技術移管の期間は、20ヶ月を想定 [2019/06/02]
Post Views: 478 BOEHRINGER INGELHEIM Boehringer Ingelhe…
投稿者