はじめに
GMP(Good Manufacturing Practice)とGCTP(Good Gene, Cellular, and Tissue-based Products Manufacturing Practice)は、それぞれ異なる製品特性に対応した製造管理基準であり、製品の性質によって適用される規制が異なる。
GMPの対象は、化学合成医薬品(錠剤、注射剤など)や、遺伝子組換え技術で作られるバイオ医薬品(インスリン、モノクローナル抗体など)、プラスミドDNA製剤(例:HGFプラスミド)、生ワクチン、遺伝子組換え微生物製剤などである。これらは細胞や組織を含まず、主に化学的または発酵・培養技術で製造される。
GCTPの対象は、細胞治療製品(CAR-Tなど)、遺伝子治療製品(AAVベクター製品)、組織工学製品(人工皮膚、骨再生マトリックス)、ヒト由来の培養細胞、iPS細胞ストック等であり、細胞や組織を直接取り扱う製品が含まれる。
エクソソーム製品は分類が難しく、製造起源や用途(医薬品か化粧品か)により、GMPまたはGCTPの適用がPMDA判断に委ねられることが多い。
分類判断は以下のフローによって行う:
- 化学合成・タンパク質製剤 → GMP、
- 遺伝子導入製剤(ウイルス、プラスミド等) → GMP、
- 細胞や組織を含むか → GCTP、
- 医療機関由来の細胞を再投与するか → GCTP、
- 研究用・ストック用細胞か → GCTP(ただし用途次第)、
- 再生・修復を目的としない場合 → GMP。
このように、製品の「構成要素(細胞・組織・遺伝子)」と「使用目的(治療・修復など)」がGMPかGCTPかの分かれ目となる。
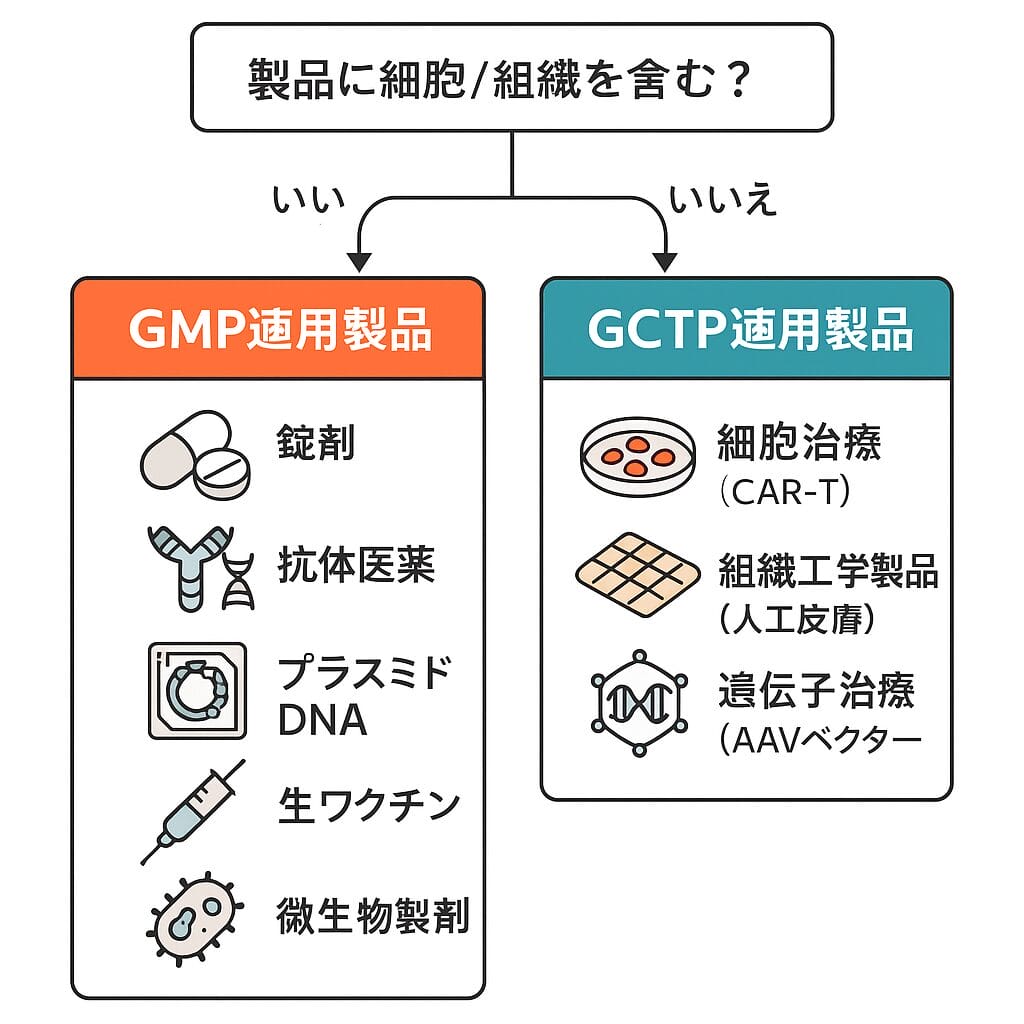
GMP対象製品 vs GCTP対象製品 分類リスト
| 区分 | 製品例 | 規制区分(対象省令) | 備考 |
|---|---|---|---|
| 化学合成医薬品 | 錠剤、カプセル、注射剤など | GMP | 化学物質を原薬とする従来型医薬品 |
| バイオ医薬品(組換え型) | モノクローナル抗体、インスリン、ワクチン(組換え) | GMP | 遺伝子組換え細胞による製造だが、再生医療等製品には該当しない |
| 細胞治療製品 | 自家培養軟骨、自己/他家免疫細胞療法(例:CAR-T) | GCTP | 医療機関由来も含め、細胞加工を伴う再生医療等製品 |
| 遺伝子治療製品 | AAVベクターを用いた遺伝子導入製品 | GCTP | 遺伝子を導入すること自体が再生医療等製品に該当 |
| 組織工学製品 | 人工皮膚、角膜、骨再生マトリックスなど | GCTP | 人体の組織・構造の修復・再生を目的 |
| プラスミドDNA医薬品 | **コラテジェン(HGFプラスミド)**など | GMP | 製造法が化学的/バイオプロセスでも、細胞を含まないためGMP |
| エクソソーム製品 | 幹細胞由来エクソソームによる皮膚再生等(医薬品・化粧品用途) | ケースバイケース(GMP/GCTP) | 細胞由来だが細胞を含まず、用途や作用機序により分類変動 |
| 生ワクチン | 麻疹、風疹など | GMP | ウイルス培養や不活化工程を含む |
| 培養済みヒト細胞の提供 | 医療機関向けの臨床用途細胞、細胞バンクでの分与 | GCTP | 細胞操作・培養を含む製品全般 |
| 遺伝子組換え微生物製剤 | 大腸菌・酵母を用いたタンパク製造(インスリン、成長ホルモン等) | GMP | 遺伝子操作されていても医薬品扱い |
■ 補足ポイント
- GMP(Good Manufacturing Practice):
品質一貫性と安全性確保のための基準。化学合成、バイオ医薬品、製剤を含む。 - GCTP(Good Gene, Cellular, and Tissue-based Products Manufacturing Practice):
細胞・組織・遺伝子製品の特性に応じた製造管理基準。再生医療等製品が対象。 - エクソソーム製品の分類は、現在も議論中の領域であり、再生医療等製品としてGCTP適用される場合もあれば、GMP適用となる場合もあります(PMDAの判断に依存)。
製品種別ごとのGMP/GCTP判断フロー
| 判定ステップ | 判断基準 | 該当する省令 | 補足説明 |
| ① | 製品が化学合成またはタンパク質製剤か? | GMP | 一般的な医薬品やバイオ医薬品 |
| ② | 製品がウイルス・プラスミドなどの遺伝子導入用製剤か? | GMP | 遺伝子治療薬、ウイルスベクター製剤など |
| ③ | 製品にヒト(自己または同種)細胞や組織を含むか? | GCTP | 細胞治療・再生医療等製品全般 |
| ④ | 医療機関等で採取された細胞・組織を原料とし、製品として再投与するか? | GCTP | 自家培養細胞製品、組織移植製品 |
| ⑤ | 非治療目的で加工された細胞(例:研究用細胞、ストック等)か? | GCTP | iPS細胞ストック等(用途により変更の可能性あり) |
| ⑥ | 上記いずれにも該当せず、かつ製品が再生・修復機能を持つことを意図していないか? | GMP | 一般薬に分類、再生医療等製品の定義から外れるもの |
編集履歴
2025/05/22, Mrはりきり (with 4o)
