タグ: transfection
-
[Bio-Equipment] 遺伝子導入装置 ; Transfection for Plasmid to cells
Post Views: 978 遺伝子導入装置 バイオ医薬品の目的タンパク質をコードする遺伝子を産生細胞株に注…
投稿者

-
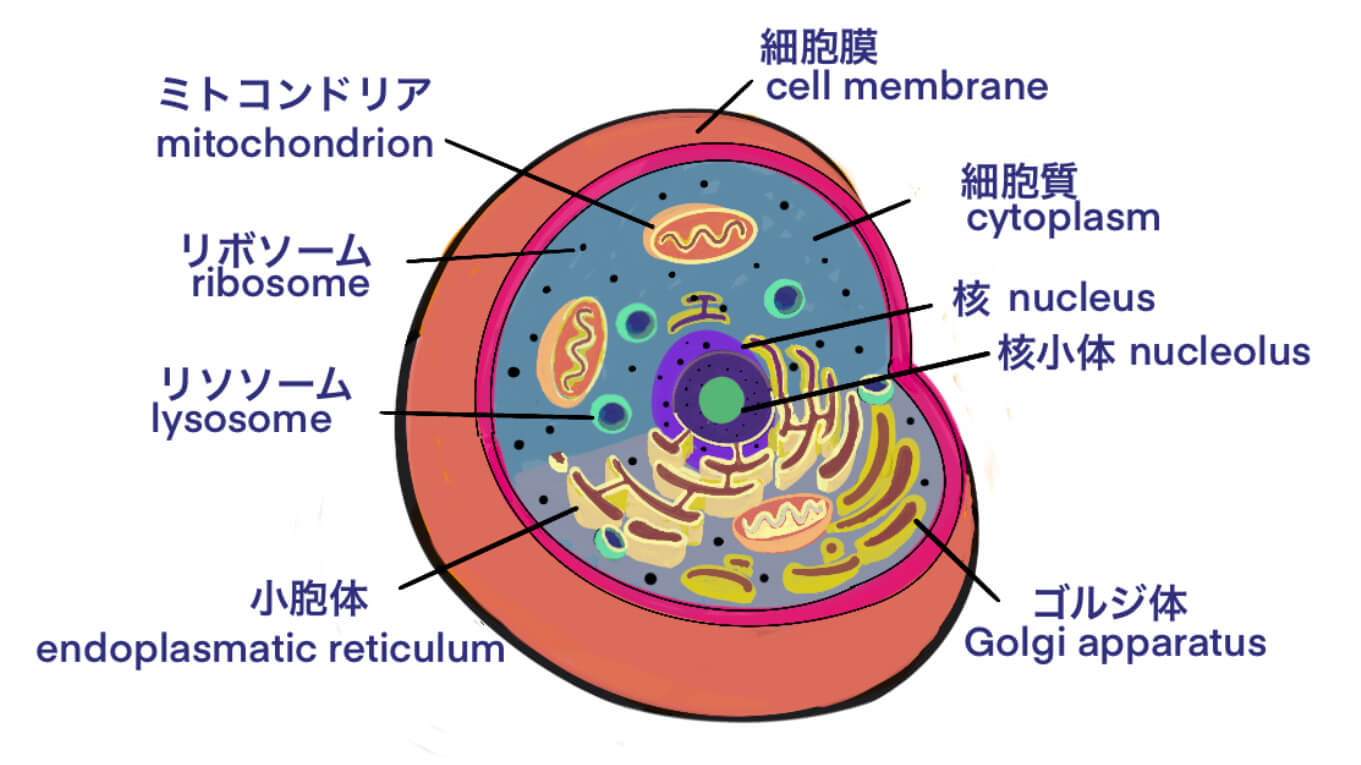
[用語] Transfection ; トランスフェクション – 遺伝子を細胞内に入れる
Post Views: 959 transfection transfection ; トランスフェクションは…
投稿者

-
[rAAV-Design] – 治療用AAV Vectorの設計 – 考慮事項 – ID12947 [2020/06/24]
Post Views: 837 もとの設計図 天然のアデノ随伴ウイルス(AAV)のゲノムは、1本鎖DNA (s…
投稿者

-
[rAAV-Production] – 治療用AAV Vector製造 – 考慮事項 – SM-ID12844 [2020/10/14]
Post Views: 936 ウイルス・ベクターと宿主細胞の準備 目標のAAVベタクー発現量 15cm ディ…
投稿者

-
[Bio-Edu] バイオ医薬品における生産細胞株の構築の方法 – ID5029 △[2020/08/19]
Post Views: 741 細胞株の構築 最近のバイオ医薬品の生産細胞株構築フローを以下に示します。 Ho…
投稿者

-
[Data Link] ウイルスベクターによる遺伝子導入と発現(4) – ID4158 [2019/12/09]
Post Views: 506 3.遺伝子導入と発現シリーズ ウイルスベクターによる遺伝子導入と発現(4)、三…
投稿者

-
[Bio-rAAV] rAAV vector製造でplasmidを細胞に導入するトランスフェクション試薬 – ID3336 [2020/07/21]
Post Views: 512 PEI Polyethylenimine (PEI)は、カルシウムよりも安定的…
投稿者