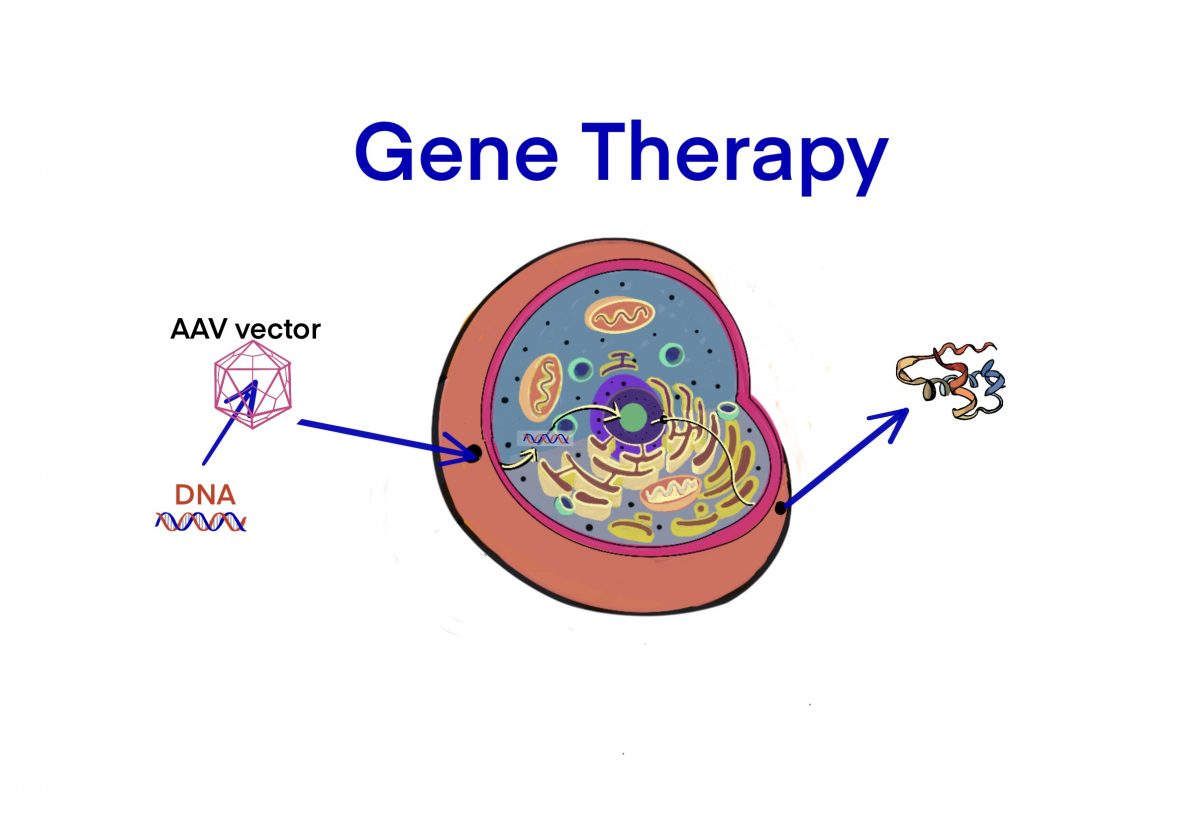
タグ: gene therapy
-
気になる企業 – Molecular Medicine ;MolMed – [2020/11/09]
Post Views: 774 ID12516 MolMed イタリア ウイルス・ベクターを用いた遺伝子治療薬…
投稿者

-
[Bio-Edu] 再生医療・遺伝子治療の市場調査 (amed-再生医療研究課) [2020/09/08]
Post Views: 945 再生医療・遺伝子治療の市場調査 日本医療研究開発機構(AMED)の再生医療研究…
投稿者

-
気になる企業 – Voyager Therapeutics – 中枢神経疾患の遺伝子治療薬の開発 – [2020/08/06]
Post Views: 894 ID20838 Voyager Therapeutics NASDAQ: VY…
投稿者

-
気になる企業 – uniQure – 血友病B遺伝子治療開発 [2020/08/04]
Post Views: 882 uniQure オランダ (Paasheuvelweg 25a 1105 BP…
投稿者

-
[Data Link] 遺伝子治療と核酸についての大要 (SCIEX – Danaher傘下) [2020/08/21]
Post Views: 844 Gene Theraphy and Olgonucleotide Compen…
投稿者

-
[Bio-Edu] AAV血清型別の組織別の感染親和性 – 感染とインテグレーション [2023/10/31]
Post Views: 922 AAVの感染とは AAVのウイルス粒子表面を覆っているカプシドタンパク質の構造…
投稿者

-
気になる企業 – AveXis – Novartis グループ – Zolgensmaを開発 [2020/06/21]
Post Views: 895 AveXis 編集履歴 2020/06/21はりきり(Mr)
投稿者

-
[Gene Therapy] 過去に日本でも実施された遺伝子治療臨床研究( まとめ) [2020/06/15]
Post Views: 853 日本の遺伝子治療研究の歴史 1995年から2006年までの間に、21の臨床研究…
投稿者

-
気になる企業 – BioMarin – 世界の開発競争を尻目に、難しいとされいた血友病Aに対する遺伝治療薬をAAV5で開発 – BLAリジェクト、P3追跡データ2年を求められる – [2020/09/02]
Post Views: 815 ID12872 BioMarin 血友病Aに対する遺伝子治療薬が現実なもにとし…
投稿者