タグ: DSP
-
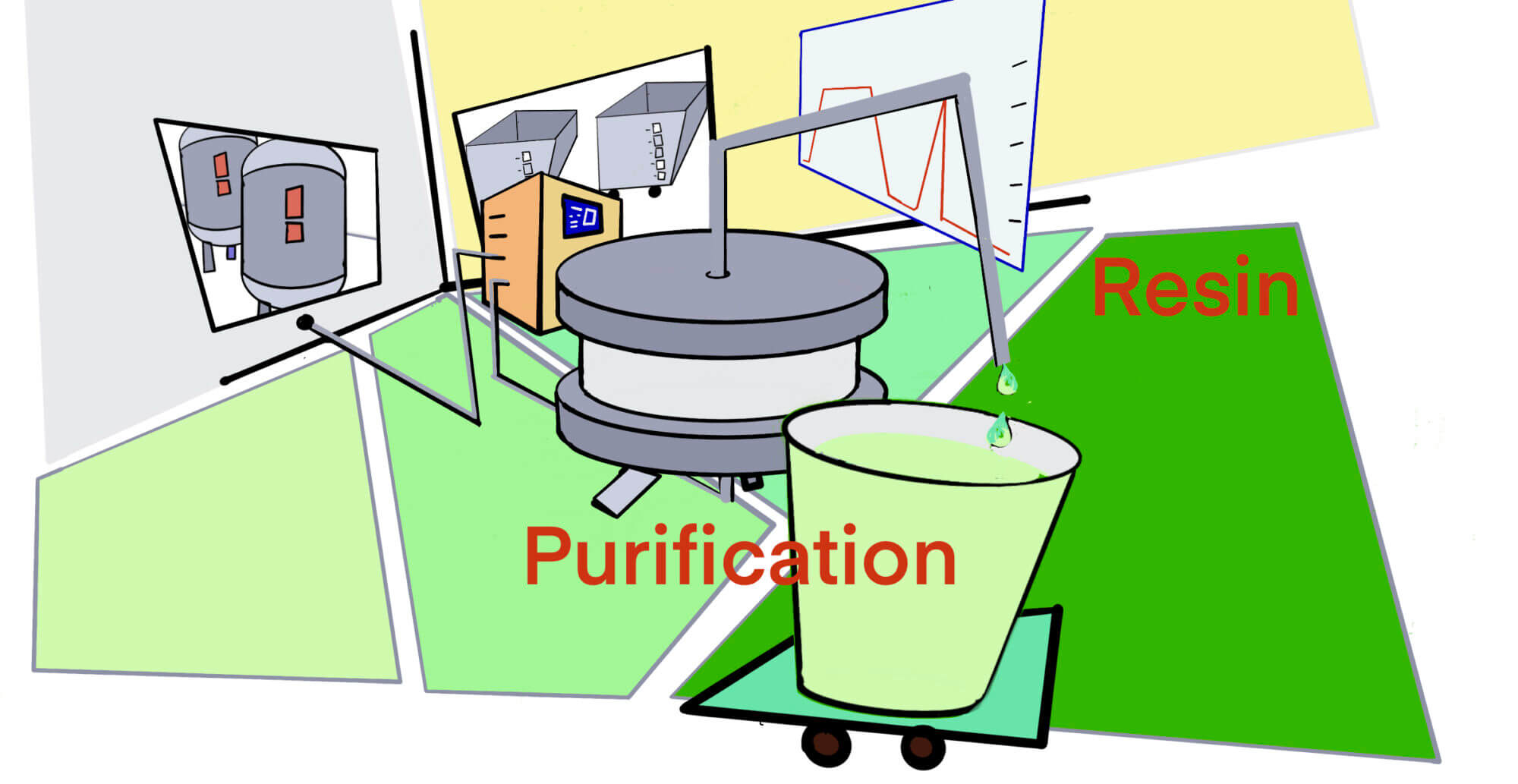
[用語] DSP; Down Stream Process [2022/11/14]
Post Views: 857 DSP DSP; Down Stream Process。バイオ医薬品の製造工…
投稿者

-
気になる企業 – Brammer Bio社 – 開発段階 から初期商用製造まで対応可能な豊富な経験を持つ遺伝子治療用の原薬 CDMO – ID11884 [2021/02/24]
Post Views: 813 ThermoFisherグループ ThermoFisherは、rAAVによる遺…
投稿者

-
[rAAV] rAAVのUSP/DSP – 製造方法 – emptyとfullの比重, 2015 – SM[2019/10/05]
Post Views: 618 rAAVの製造 2015年時点のrAAV製造(Upstream, Downst…
投稿者

-
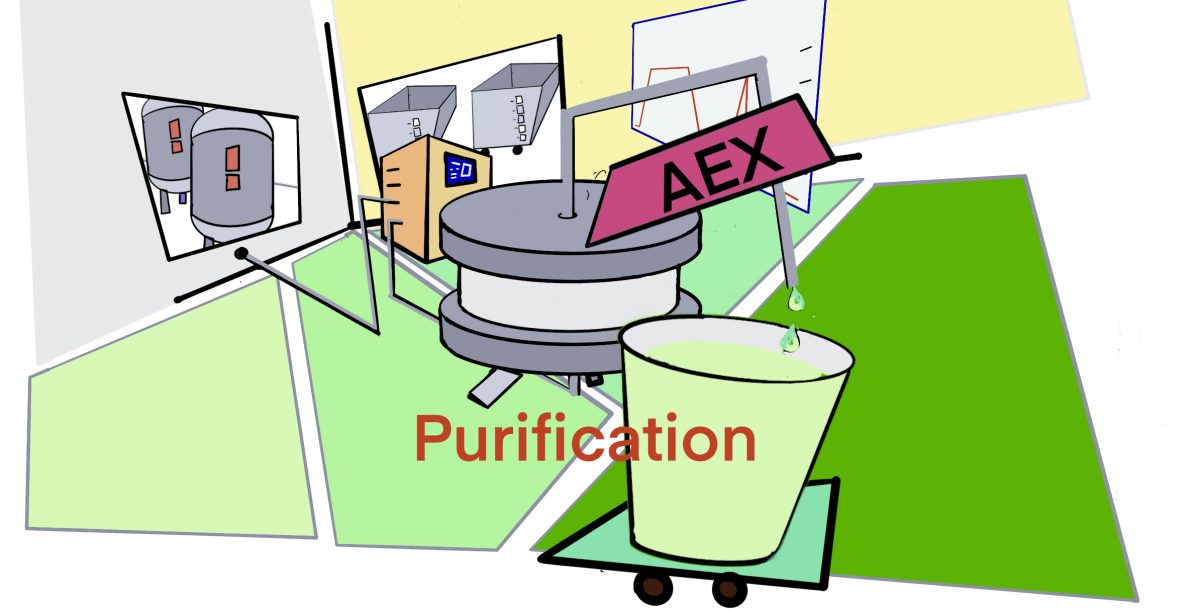
[rAAV-Edu] rAAV9の精製方法 – 特許, 2017 – ID2566 [2023/10/23]
Post Views: 483 概要 リコンビナントAAV(rAAV)の大規模精製方法に関する方法特許(Met…
投稿者