タグ: DNA
-
バイオ医薬品に不純物として含まれるDNAや核酸など,がん原性のリスクはないのか [2025/03/20]
Post Views: 407 遺伝子治療で使用されるAAV製品などでは,断片化したDNAである不純物がある程…
投稿者

-
[用語] UNA; unlocked nucleic acid [health] [2023/10/14]
Post Views: 823 はじめに UNAは,人工的に作られたヌクレオチドであり,構造フレキシビリティが…
投稿者

-
[Bio-Edu] DNAとRNAの違い – レジメ – [2020/10/11]
Post Views: 1,051 ID24191 DNAとRNAの違い DNAはRNAの設計図になります。R…
投稿者

-
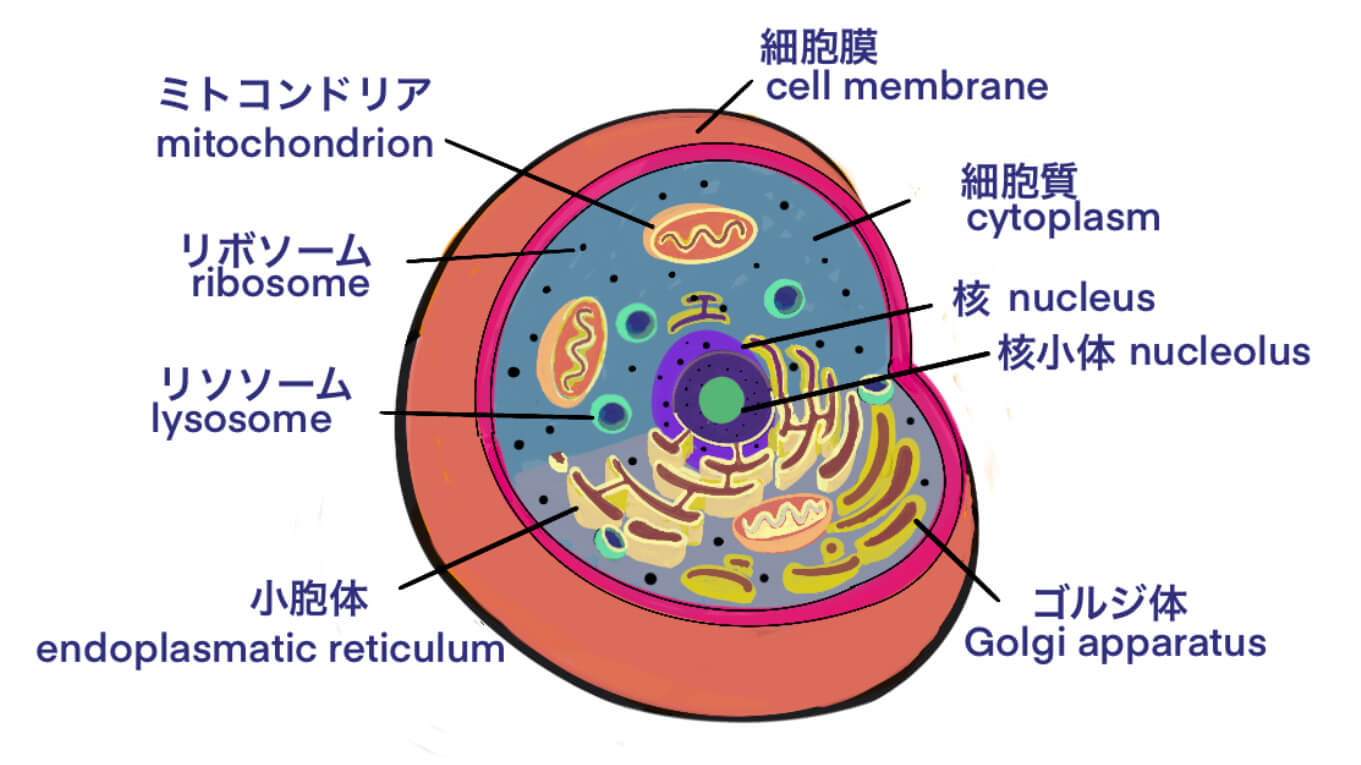
[用語] DNA; Deoxyribonucleic acid – Histoneを介した染色体の折り畳みまでを順を追って解説 [2020/09/23]
Post Views: 955 DNA DNA; Deoxyribonucleic acid; デオキシリボ核…
投稿者

-
[Vc] mRNAワクチンの優位性 (Morderna社) – 従来ワクチンとの比較 – ID15083 [2020/05/03]
Post Views: 857 mRNAワクチンの優位性 最初に、核酸ワクチンと従来ワクチンとの比較で、核酸ワ…
投稿者

-
[Vc] 核酸ワクチンとは DNAワクチンとmRNAワクチン – ベクターワクチンとの違い – ID15040 [2020/09/10]
Post Views: 995 ID15040 核酸ワクチン ワクチンの目的は、病原性の抑制に直接的/間接的に…
投稿者

-
[Bio-Edu] DNAワクチンとは – 2008年までの論文から、免疫細胞へのプラスミドDNAの取り込みにより特異抗体が産生される – ID13931 [2020/04/21]
Post Views: 921 DNAワクチンとは 1998年、2000年および2008年の論文から、DNAワ…
投稿者

-
[Bio-Material] GMP製造に使えるNucleaseの種類と価格 – ID3859 [2019/12/09]
Post Views: 497 はじめに AAVベクターを製造する場合、宿主細胞の破砕によりDNAが溶液中に混…
投稿者