タグ: company
-
気になる企業 Pall – ろ過膜の総合メーカー / グループ親会社Danaherのもう一つのバイオ関連企業であるCytivaと共にバイオ関連需要に対応すべく関連増資を進める [2021/12/04]
Post Views: 974 Pall Pallは、バイオ技術ソリューション企業です。 会社情報 US Da…
投稿者

-
気になる企業 – Voyager Therapeutics – 中枢神経疾患の遺伝子治療薬の開発 – [2020/08/06]
Post Views: 894 ID20838 Voyager Therapeutics NASDAQ: VY…
投稿者

-
気になる企業 – Sanofi – 新型コロナワウイルス・ワクチンの開発を組換えタンパク質ベースとmRNAで臨床試験が進められている [2021/03/12]
Post Views: 914 Sanofi France (54, rue La Boétie 7…
投稿者

-
気になる企業 – uniQure – 血友病B遺伝子治療開発 [2020/08/04]
Post Views: 882 uniQure オランダ (Paasheuvelweg 25a 1105 BP…
投稿者

-
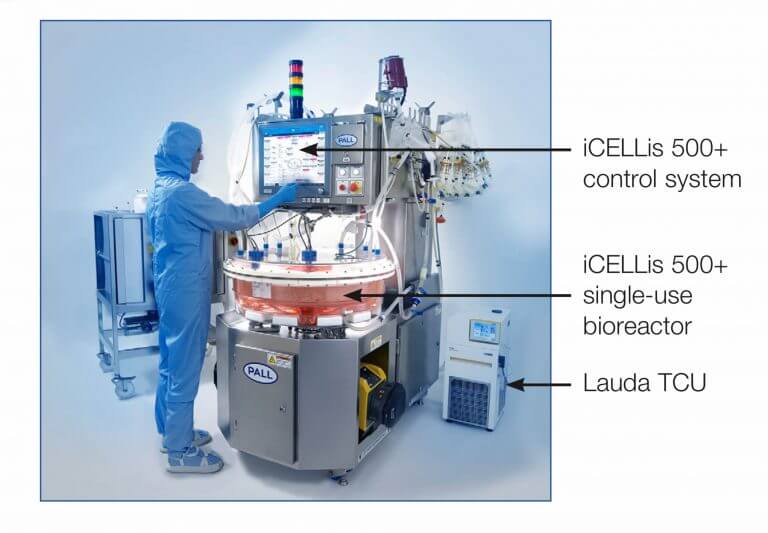
[Bio-Equip] iCELLis – Single-Use Fixed-Bed Bioreactor system – by PALL [2020/07/27]
Post Views: 842 Bio-Equipment iCELLis 吸着性の細胞を培養するシングル・ユ…
投稿者

-
気になる企業(だった) – New Brunswick Scientific (NBS) [2020/07/26]
Post Views: 495 New Brunswick Scientific (NBS) NBSの培養装置…
投稿者

-
[Vc] Moderna – COVID-19 ワクチン臨床(Phase 3の中間結果は94.5%の有効性を示した – ID19527 [2020/11/16]
Moderna社は、新型コロナウイルスのmRNAワクチンを開発している。臨床は、Phase 3を進めており、中…
投稿者

-
[Vc] Pfizerの新型コロナウイルスに対するmRNAワクチン – Pfizer-BioNTech COVID-19 Vaccine の組成 [2021/06/10]
BioNTech社とPfizerが共同開発するmRNAをベースの新型コロナウイルス感染症に対するワクチンです。…
投稿者

-
気になる企業 – AstraZeneca; アストラゼネカ [2021/01/28]
Post Views: 1,009 AstraZeneca AstraZeneca HOME PAGE サイト…
投稿者

-
気になる企業 – GSK; グラクソ・スミスクラインは、世界最大のワクチン企業 – 抗体医薬は3品目 [2020/07/21]
Post Views: 914 GSK 世界最大のワクチン開発企業 サイトから、2019年の売上高を調べた 2…
投稿者