タグ: CMO
-
気になる企業 – パセオン(patheon) – ThermoFisherグループ – 抗体/rAAV – ID3631 [2020/08/20]
Post Views: 593 パセオン https://patheon.com Thermo Fisherグ…
投稿者

-
気になる企業 – DM Bio – Meiji Seikaファイルマグループ – 韓日両国の強力で誕生したバイオ医薬品専門企業 – ID3543 [2021/06/06]
Post Views: 522 DM Bio DM Bioは、Meiji Seikaファルマのグループ会社。韓…
投稿者

-
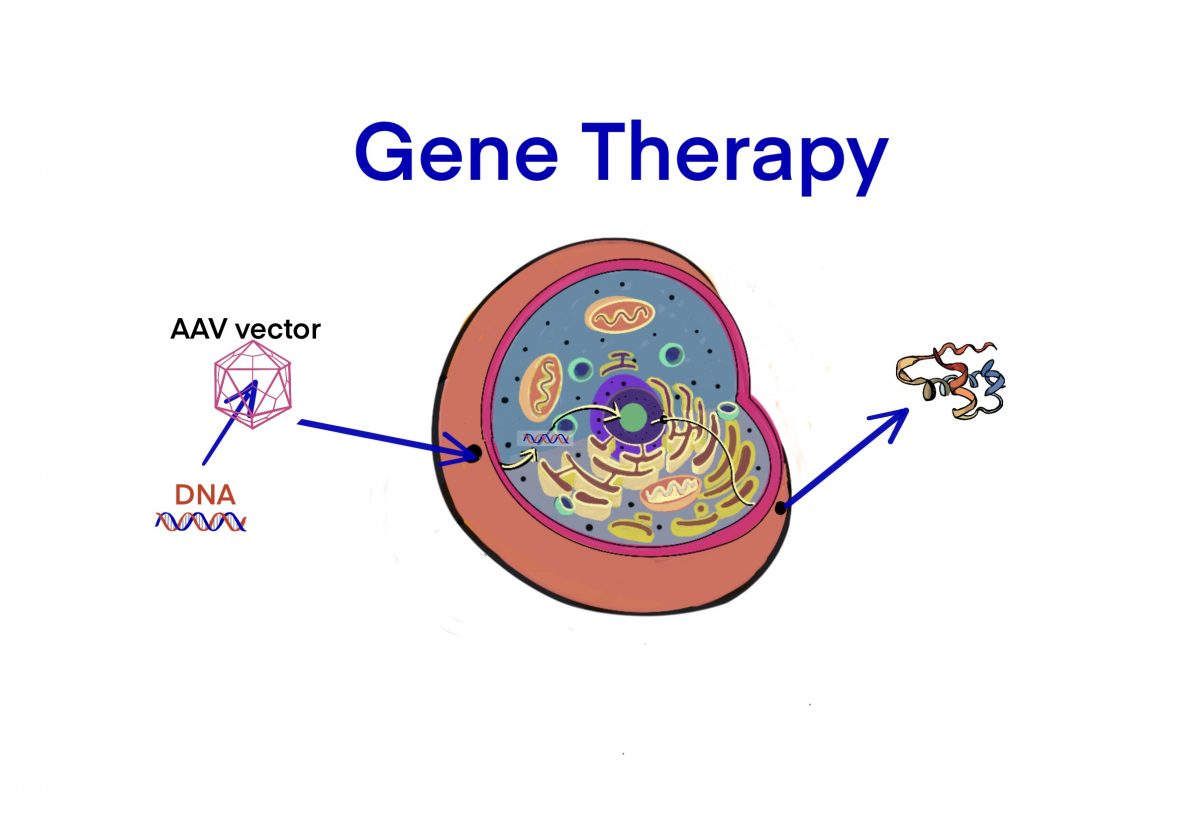
[Bio-rAAV] 遺伝⼦治療における代表的な委託製造会社 (CMO) – ID1881 [2021/02/08]
Post Views: 468 rAAV vectorを製造するCMOリスト 企業サイト サイト 製造サイト …
投稿者

-
[用語] CMO; Contract Manufacturing Organization; 医薬品製造受託会社
Post Views: 906 CMO CMO; Contract Manufacturing Organiz…
投稿者