タグ: cell bank
-
[ICH Q5D] バイオ医薬/既存の生産株から新しい生産株への変更は可能か? 同等性/同質性 (comparability) の確認が必要 – 特性解析だけでは済まない! /事例も含めて解説 [2025/04/17]
Post Views: 605 はじめに Comparability(同等性評価)は、バイオ医薬品の製造工程や…
投稿者

-
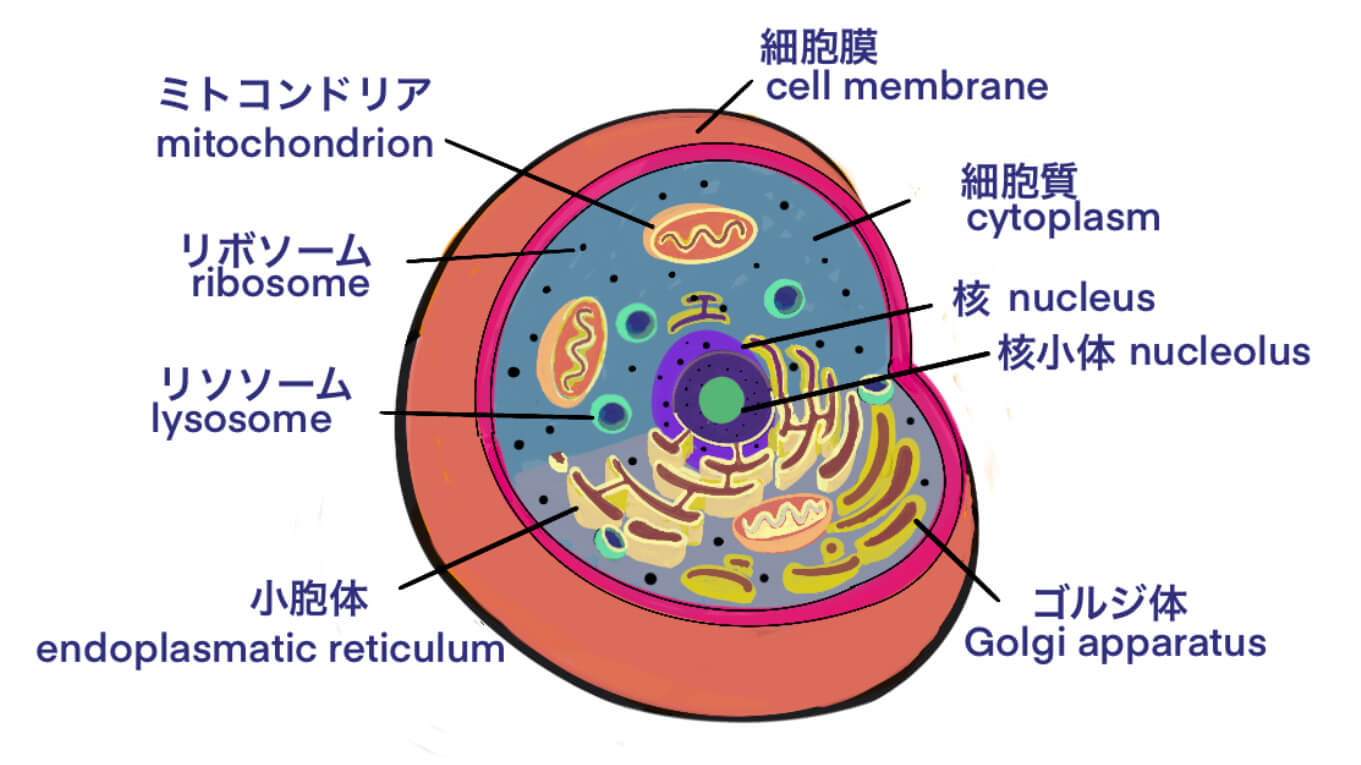
[Bio-Edu] バイオ医薬品 (バイオロジクス)は、CHO細胞の技術革新と共に進展してきた [2020/08/05]
Post Views: 1,006 バイオ医薬品とは バイオ医薬品は、英語でバイオロジクスと言います。バイオロ…
投稿者

-
[rAAV-Design] – 治療用AAV Vectorの設計 – 考慮事項 – ID12947 [2020/06/24]
Post Views: 837 もとの設計図 天然のアデノ随伴ウイルス(AAV)のゲノムは、1本鎖DNA (s…
投稿者

-
[Bio] 細胞の同一性試験 – DNA Finger Printing Test (Random amplified polymorphic DNA; RAPD) – ID12852 [2020/03/31]
Post Views: 770 細胞の同一性 アイソエンザイム解析 細胞株の同一性試験としては、規制当局の要件…
投稿者

-
[Bio-Process] 細胞バンク – ID9833 [2020/02/01]
Post Views: 689 生産細胞株 通常、Cell Bankの保管は、劣化を極力抑えるために液体窒素蒸…
投稿者

-
[Bio-Edu] 高分子蛋白質の組換え宿主細胞として大腸菌、酵母に勝るCHO細胞 – ID6629
Post Views: 691 大腸菌 大腸菌では、翻訳後修飾における糖鎖付加機能がないものの、糖鎖の付加がさ…
投稿者