カテゴリー: BIOLOGICS
-
[用語] NeeS ; Non-eCTD electronic Submission – 医薬品の承認申請関連用語
Post Views: 663 NeeS : Non-eCTD electronic Submission, …
投稿者

-
バイオロジクスの実製造プロセスと装置および機材 – ID20713 [2020/02/29]
Post Views: 1,006 バイオロジクスの実製造 抗体医薬の製造は,プラットフーム化され,既にコモデ…
投稿者

-
満を持して新世代PCR装置発売、コロナウイルスを15分で測定 – ジーンソック (GeneSoC) – キョーリン製薬 (PCR原理を含めたまとめ) – △ID10926
Post Views: 1,057 GeneSoC GeneSoc 遺伝子検査定量装置 GeneSocは、キョ…
投稿者

-
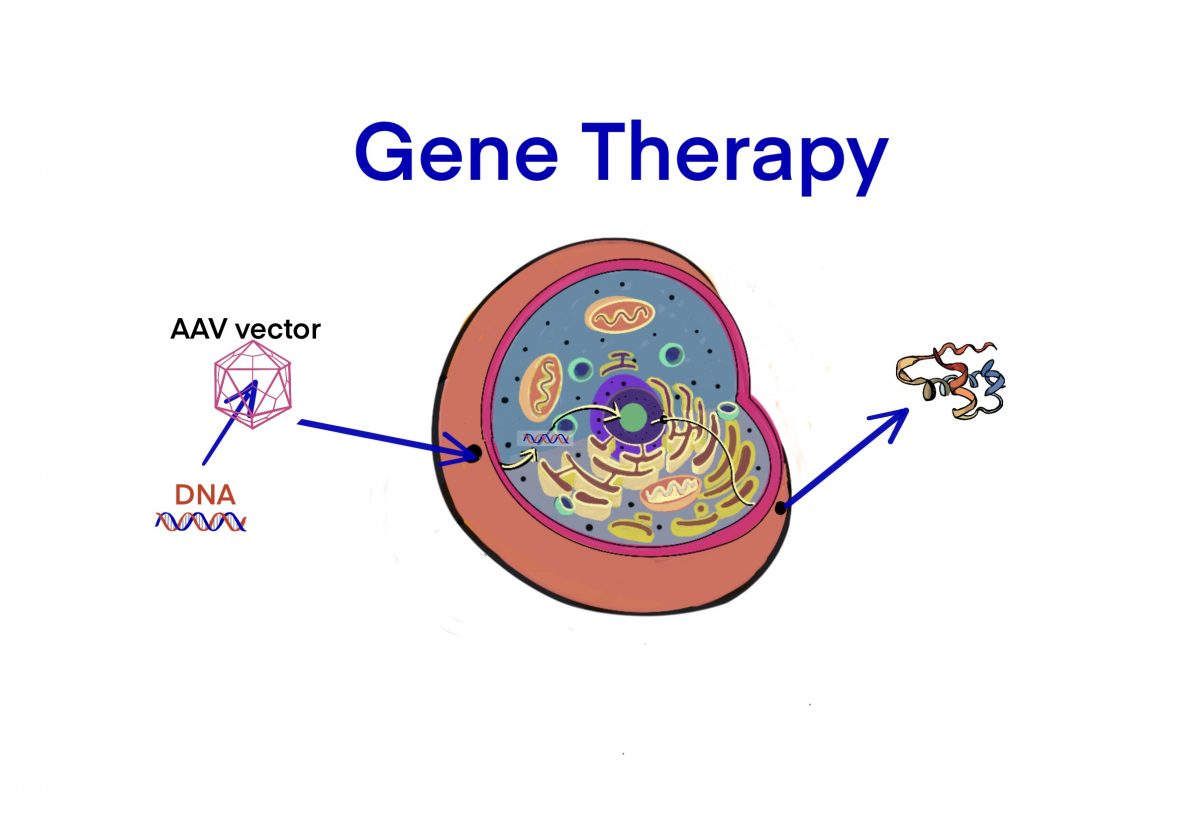
[ゲノム編集] デュアルAAVデリバリーシステムによるマウスのデュシェンヌ型筋ジストロフィーの治療研究 (CRISPR-Cas9を補助する) – ID9877 [2020/08/22]
ジュジェンヌ型筋ジストロフィーの治療薬の研究として、AAVを活用したゲノム編集型遺伝子治療研究の文献を概説し、…
投稿者

-
[Bio-Material] ポリッシング用精製担体 – CHT (セラミック・ハイドロキシアパタイト)とは、BIO-RAD – ID9865
Post Views: 709 CHTについて BIO-RAD製品 通常は、針状結晶で脆い結晶性ハイドロキシア…
投稿者

-
[rAAV-Material] AAVpro® Helper Free System – ID9843 [2020/02/19]
Post Views: 714 研究用試薬である。生じたいかなる損害に対して責任を負わない。ライセンス締結は、…
投稿者

-
[用語] HPLC : High Performance Liquid Chromatography
Post Views: 707 HPLC : High Performance Liquid Chromato…
投稿者