カテゴリー: BIOLOGICS
-
[Vc] J&J/Janssen – 新型コロナウイルスに対するワクチン[2021/08/02]
Post Views: 987 Janssen 米国で承認および推奨されているCOVID-19ワクチンには、P…
投稿者

-
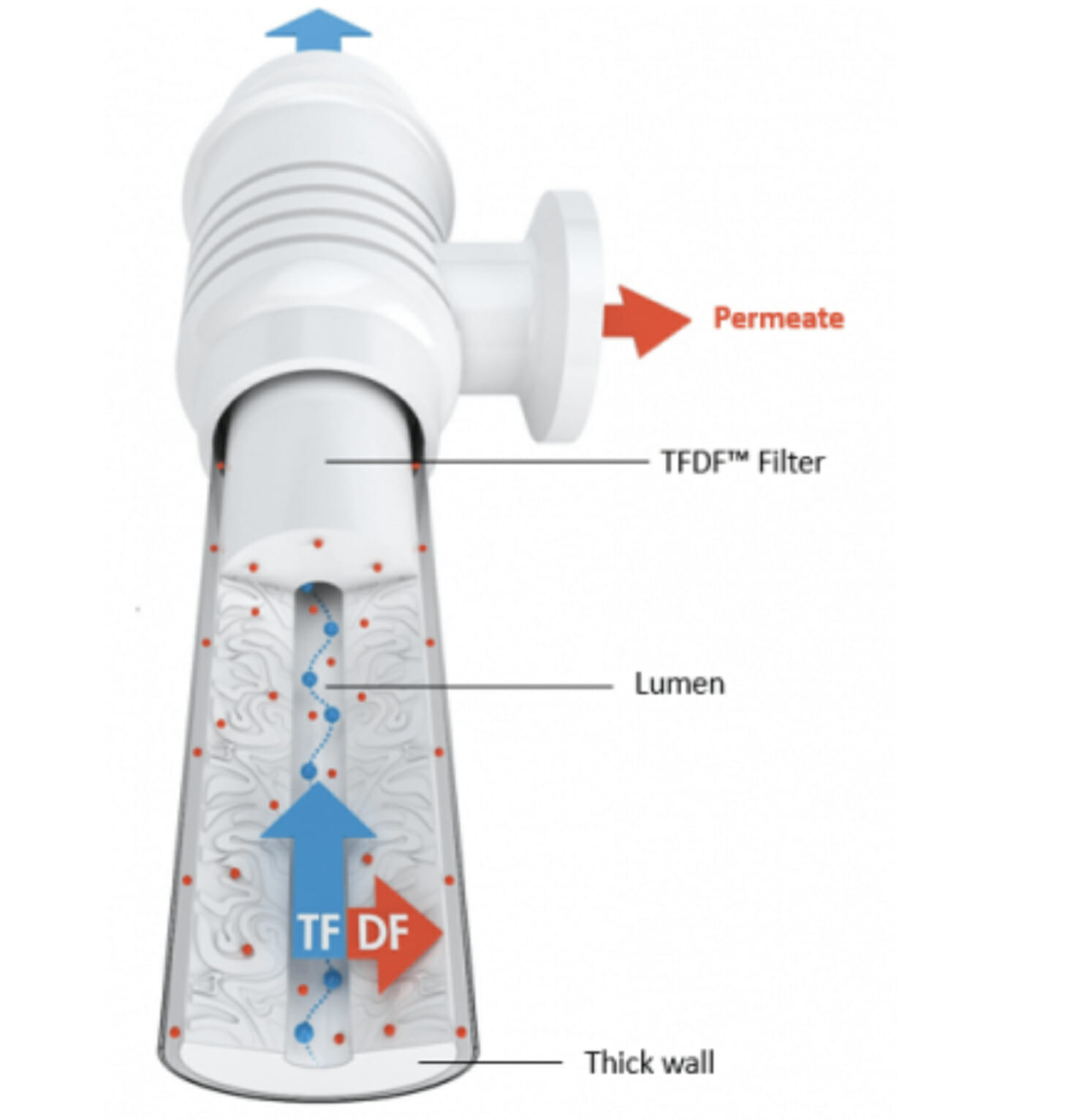
[Bio-Equip] TFDF – TFFの構造にdepth filterを採用して、高細胞濃度でも濾過能力を高める技術 – REPLIGEN [2021/07/26]*
Post Views: 1,051 はじめに バイオ医薬品をつくるには,種々の高価な装置が必要です.MRHAR…
投稿者

-
[Bio-Process] 配列からベクターDNAを作るまでの工程 [2021/06/14]
Post Views: 868 遺伝子配列からベクターDNAを作る 編集履歴 2021/06/13, Mr. …
投稿者

-
[抗体医薬] アルツハイマー病治療薬: Biogen & エーザイ 共同開発 ADUHELM はアメリカでは条件付き承認,エーザイ& BioArctic AB共同開発のlecanemabは日本で承認取得[2023/10/11]
Post Views: 995 アデュカヌマブ 痴呆症の内の60%は、アミロイドβが蓄積して脳の神経細胞を壊す…
投稿者

-
気になる企業: Novavax 新型コロナウイルス・ワクチンには、遺伝子組換えタンパク質とナノパーティクルの技術で挑む[2022/04/01]
Post Views: 944 はじめに 欧州では2021年12に承認されたVOVAVAXのCOVID-19ワ…
投稿者

-
[特許] FTO調査 – 自らの技術が特許侵害していないか [2021/05/07]
Post Views: 976 はじめに 医薬品開発においてコマーシャル製造する場合,工業的に製造という制限と…
投稿者

-
[Bio-Culture] 大腸菌; E.coliの増殖率は細胞長の増大に関わる [2021/02/27]
Post Views: 1,056 大腸菌の増殖率 一般的に、大腸菌の増殖率(growth rate)、1時間…
投稿者

-
[Bio-Culture] Poloxamer 188 (Pluronic F-68) – バイオリアクターの撹拌翼による細胞のダメージを抑制 [2021/02/24]
Post Views: 1,148 Poloxamer 188 Poloxamer 188という名称は、馴染み…
投稿者