atmos dining
コンラッド大阪の40Fにアトモス・ダイニングがあります。食事のバイキングは、それなりに高級なので美味しくいただけます。
ここはやはり、ロケーションです。周りに高いビルがないため、ビューは素晴らしいのです。
バイキング

40F
40Fはホテルのロビーになっています。エレベータで一気に上がれば、ガラス張りの大阪の街を望めますよ。夜は夜景の灯りで良いですが、昼は生駒山を望むことができてこれも素晴らしい景色です。
















夜景


2016年建設途中
右手が梅田方面です。コンラッド大阪は、このツインビルの左側のビルに入っています。まだ、2016年2月では建設途中でした。右側のビルは、フェスティバルホールが入っています。


編集履歴
2020/05/17 はりきり(Mr)
以上
![[Hotel] コンラッド大阪 – アトモス・ダイニング [2018/08]](https://harikiri.diskstation.me/myblog/wp-content/uploads/2021/02/80F3D755-3019-49C6-BDAE-47D137C87826.jpeg)
![[Hotel] リーガロイヤルホテル – 広々としたメインラウンジで苺の和風デザート [2020/05]](https://harikiri.diskstation.me/myblog/wp-content/uploads/2020/05/F726AD7F-AB74-4261-A125-36FD8D2B4695.jpeg)

















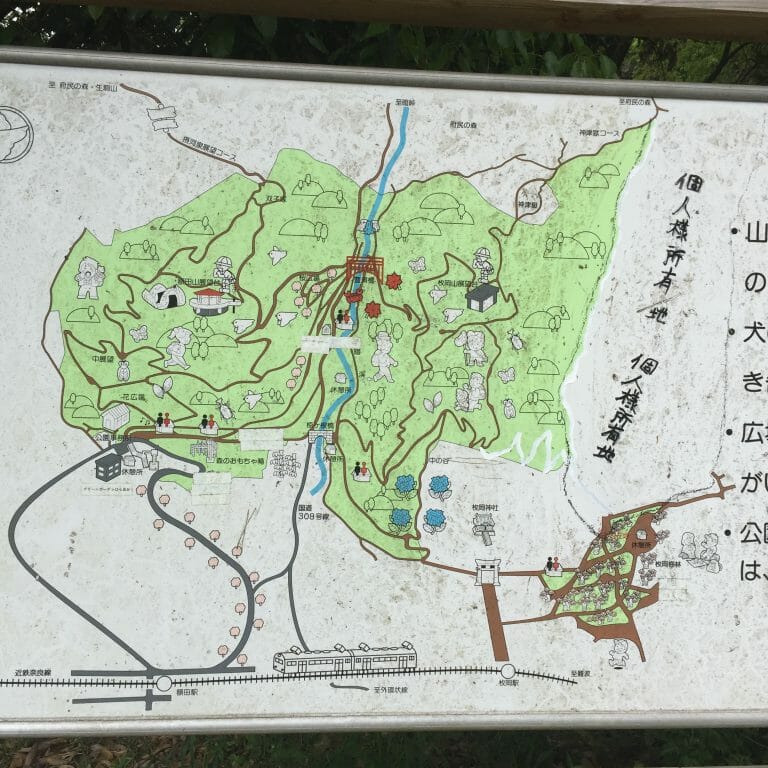
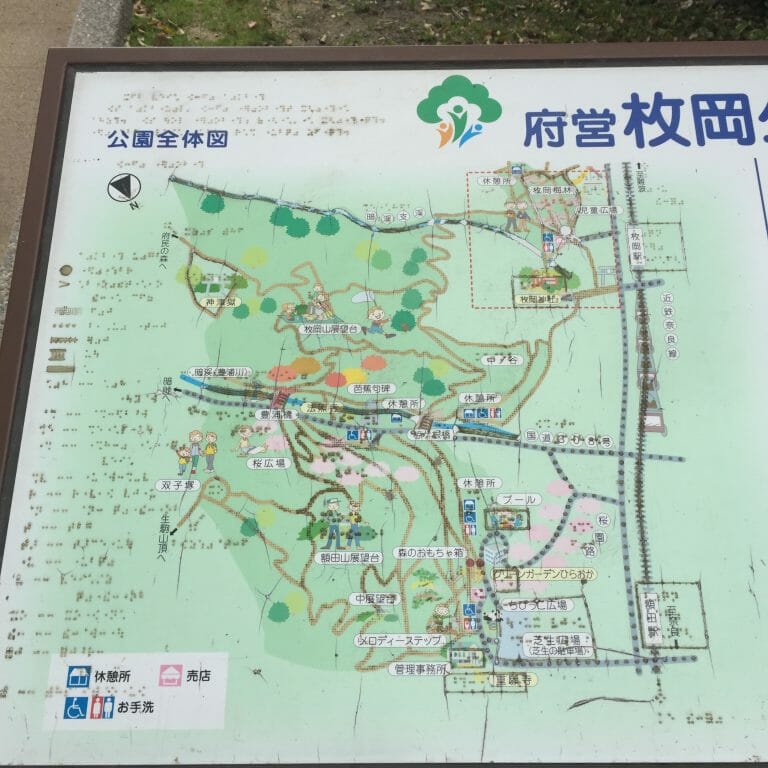
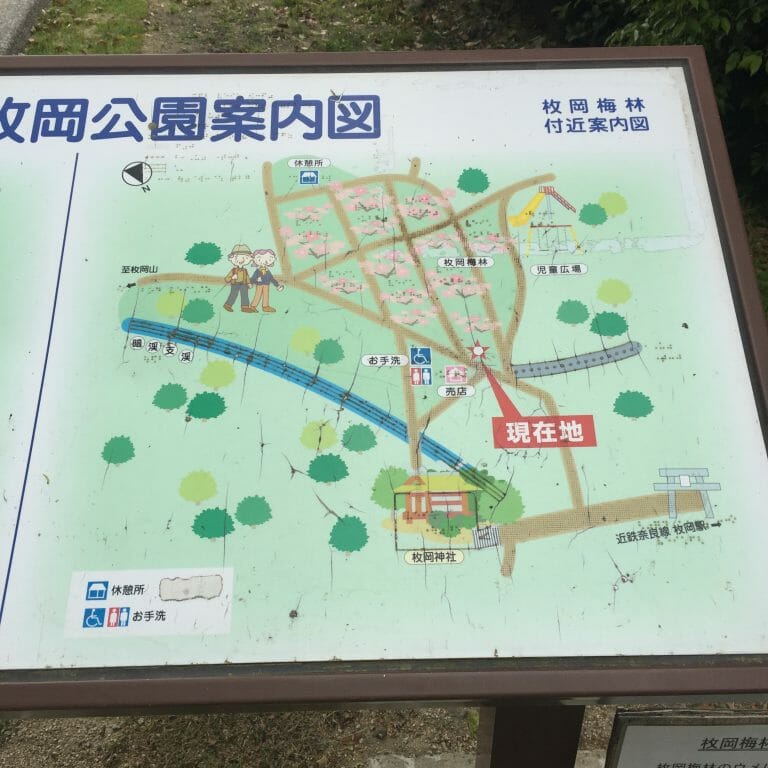
![[Trip] 枚岡神社 – そんなに標高は高くないが、大阪平野を見渡せる-パワースポット:枚岡公園がある [2020/12/25]](https://harikiri.diskstation.me/myblog/wp-content/uploads/2020/05/351A83EF-0203-4218-9118-DA022891A8F1.jpeg)


























![[Trip] 生駒山「宝山寺」- 崖に望むパワースポット、参道の店舗も魅力的 – ID13760 [2020/05/17]](https://harikiri.diskstation.me/myblog/wp-content/uploads/2020/05/2604BE10-CE8C-41D5-87D3-120038A282C2.jpeg)













![[Kw] ラニチジン – 胃薬に使用されるヒスタミンH2受容体拮抗薬 – 製造過程/保存過程で発癌物質NDMAが生成されやすいらしい](https://harikiri.diskstation.me/myblog/wp-content/uploads/2020/09/0E1A8FDA-ABDA-4D42-811D-BE0041CBB6CB.jpeg)
![[Data Link] mRNAワクチンの情報収集 – ID15773 [2020/05/16]](https://harikiri.diskstation.me/myblog/wp-content/uploads/2019/12/165D7DBF-D051-4159-BA21-AD22D8451309.jpeg)
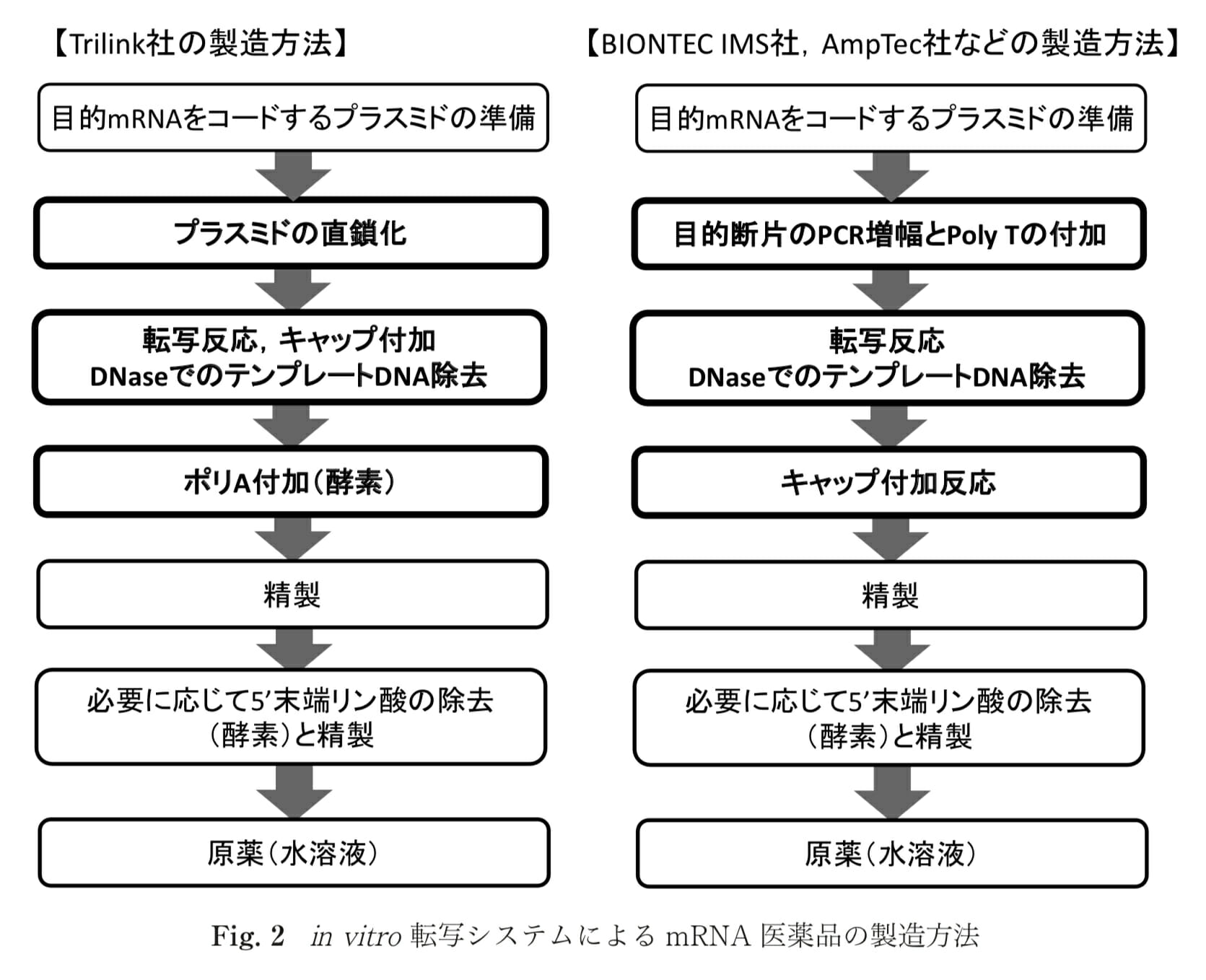
![[Vc] mRNAワクチンの製造方法、moderna社とBiaseparations、その他から概略を学ぶ – ID15769 [2021/05/10]](https://harikiri.diskstation.me/myblog/wp-content/uploads/2021/02/B886265D-DB46-4164-9376-36ACBE241A2C.png)
![気になる企業 – Arcturus Therapeutics – mRNAによる希少疾患とワクチン開発に特化 – ID15742 [2020/05/16]](https://harikiri.diskstation.me/myblog/wp-content/uploads/2019/10/B4F24978-42E9-477E-92B0-94605AEBEAB4.jpeg)