Post Views: 1,337
ID17195, [2020/08/22]
やめれるものなら、「フェブリク」をやめたい
薬を継続して飲むことに抵抗があります.フェプリクは,高尿酸血症の治療薬です.若いころから血中の尿酸,尿素窒素の検査値が高めでした.中年以降,手指の関節通が起こるようになり,高尿酸血症治療用の「飲み薬」を処方されてからは,その痛みはなくなりました.数年継続して飲み続けましたが,症状が緩和しだすと人間は調子のいいもので,どうにかして投薬をやめれないかと思うようになりました.いずれを選択しても,メリット・デメリットを考えて合理的な判断をして後で後悔しないようにしたいと色々と調査・考察しました.
痛風(gout)は、高尿酸血症により引き起こされる指の関節痛で、足の親指の関節の痛みが、典型的な症状です。最近では、高尿酸血症は、その他の疾病に対してリスクを高めている ことが分かってきています。私の場合は、投薬の契機となったのは、足の親指の関節以外に、手指の関節痛が出だした時でした。もう薬を飲むしか無いと思いました。
フェブリク
2011年に承認され、日本では帝人が販売している高尿酸血症治療薬は、その効果は、患者の前提条件を選ばず高いのでが、以下のような記事 があります。
この記事を読んで、フェブキソスタット(以下フェブリク)をやめたいと思いました。
そのフェブリクの服薬の開始から一時的に3か月間、服薬やめて、その後、検査を受けその結果から、服薬を再開した経過を記録しました。
私にとって、(1) 取り立てて副作用(10mgから途中20mg/日)も、今まで出ていないこと、(2) 残念ながら,服薬をやめると足の親指の関節痛が現れてくること,(3) 血漿尿酸値は約5前後でコントロールした方が良い こと、等を踏まえて再開し、今後も続けていくことで落ち着きました(当時,2022/08/22)。
といいながら,あきらめが悪いのが,はりきり(Mr)です.水分摂取量について「ヘルスハック」をしています.痛風の原因が尿酸であるというのは,一般的ですが,クレアチニン値も気になっている,はりきり(Mr)なので,性懲りもせず自分自身で実験をしています.以下の記事も見て下さい.どうしても症状をコントロールできない場合は,服薬するのが最善だと思います (by Mr.Harikiri, 2022/10/02).
健康に生活するための適正な水分摂取量について「ヘルスハック」! ( by はりきり(Mr) )
[健康] 血中クレアチニン(Cr)濃度とeGFR /関連表の理解と腎機能の閾値 – 水分の摂取量でクレアチニン(Cr)を何時かは下げれるかも(只今実験中: もう1年続けた結果) – eGFRはCr, 年齢, 性別で計算 [2022/10/02]
20mg/日(1錠)
約5年服用で副作用はない
3ヶ月服用をやめてみたところ、足親指の関節痛が出てきた
3ヶ月後の尿酸値は、正常範囲から超えた
アロプリノール(ジェネリック含め23品目薬価掲載されている)へ戻らない理由
服作用がフェブキソスタット(1品目薬価掲載)よりも多いことと
白内障の進行が早まったこと
1ヶ月の薬剤費と診療費の実績は、アロブリノールで700円程度と比べてフェブキソスタットが1100円程度と少々高い程度であること。(2020/08現在1000円)
やめたいと思ったきっかけ
心筋関連のリスク
全日本民医連より
『開発中に偽薬と比べ心血管系イベントが高くなる傾向があったため、米国食品医薬品局(FDA)は心血管疾患に対する安全性の検証を求め、「心血管疾患既往のある痛風患者で、高尿酸管理に使用されている尿酸生成を抑制するフェブキソスタットが主要心血管イベントにおいてアロプリノールに対し非劣性であるかを検証する」臨床試験(CARES試験:症例数6190例・武田薬品工業)が実施されました。市販後の調査の結果、2019/7/2の時点で、アロプリノールとフェブキソスタットで、心血管系イベント(発症率)には差がありませんでした。一方で、個別の評価項目に設定された、心血管死、および全死亡がフェブキソスタット群で有意に高いという結果でした(心血管死:フェブキソスタット群4.3%、アロプリノール群3.2%、ハザード比1.34、p値0.03。全死亡:フェブキソスタット群7.8%、アロプリノール群6.4%、ハザード比1.22、p値0.04)。この結果を受け、薬害オンブズパースン会議は「痛風治療剤フェブキソスタット(商品名: フェブリク)はアロプリノールに比較し、心血管リスクの高い患者で全死亡と心血管死が有意に多い」と注意喚起している。』
この記事の続きには、
『個別の副作用を考えることも大事ですが、このような大規模臨床試験の結果は、慎重に受け止める必要があるでしょう。フェブリクについては、当モニターには乏尿の副作用が1件、PMDAには2018年までに心不全15例、心筋梗塞3例が報告されています。」
と述べられている。
一般の患者にとっては、問題視するほどのことでは無いかもしれないが、やめれるものならやめたいと思いました。
添付資料の記載
添付文書にも記載がりあます。
添付文書情報 2019年7月 改訂(薬生安通知に基づく改訂) (第9版) -> 使用上の注意 -> 重要な基本的注意より
心血管疾患を有する痛風患者を対象とした海外臨床試験において、アロプリノール群に比較してフェブキソスタット群で心血管死の発現割合が高かったとの報告がある。本剤を投与する場合には心血管疾患の増悪や新たな発現に注意すること[「その他の注意」の項参照]。
服薬に至るまで
親指の関節の鈍痛は10年以上前から
左足親指の付け根の関節痛(鈍痛)は、相当以前の30歳代からありました。
筋トレやプリン体を多く含む食事も好きだったこともありましたが、昔の「健康診断」の数値を読み返してみると、就職した20歳代から、尿酸値は、「6~7」で、それ以降、治療を開始するまで、低下することはありませんでした。体質という遺伝的要因が関わっていると思います。フェブリクの服薬開始から徐々に低下してして尿酸値は「5」代になりました。
話を戻して、年齢を重ね、50歳になる数年前から尿酸値が、上がり出しました。加齢は当然ですが、ストレスもあり健康的な生活ができていなかったと思います。
体調の悪いことについて、「男の更年期」などと周りにはいって、笑って過ごしていました。
服薬のきっかけ
治療薬の服薬のきっかけになったのは、日頃から両足親指の「鈍痛」に加え、両手の手指の中指や人差指の関節痛が生じてきたことでした。肩の痛みもありました。日常の生活に支障をきたすようになりました。まさかと思いながら、かかりつけ医を受診しました(52歳)。
尿酸値は、とうとう”8”を超えていました。素人判断としても高尿酸結晶による「痛風」かも知れないとは思っていました。
症状自体は、痛風の発作と呼ばれる「急な関節の激痛」は、これまで一切なかったため、まさかと思っていました。後ほど述べていますが*)
話を戻して、やはり、掛付け医からは、「痛風」の治療薬である「アロプリノール」を処方をされました。
しかし、アロプリノール服用後1ヶ月程度で、足親指関節と手指関節の「鈍痛」は消えました。途中にフェブリクに切り替えています。
アロプリノールを1年間服用 (2014/03~)
フェブリク (2011年に承認された薬剤)に変更 (2015/03 ~ 2019/09執筆時点で4.5年間服用、更に2021/02で6年間服用 )
アロプリノールの副作用かも
白内障?
だだ問題だったのは、アロプリノールを1年服用を続けて、その後、フェブキソスタットに切り替えてから直ぐのある日、目が霞むことに気付づきました。
この時点では、どちらの薬剤による影響なのか、それとも全く別の原因なのかは分からりませんでした。
白内障かどうかも不明ですが、白内障は、光の散乱が主な理由で霞むように見えるといいます。
私の場合は、霞んで見える遠くの景色は、いくら目を細めて見ても霞んだままでしか見えませんでした。そのように霞んで見える症状は、1年前では自覚はありませんでした。白内障の治療の顛末についても記事にしています。
アロプリノールの副作用情報に白内障
これまで服用していたアロプリノールの副作用か、飲み始めてすぐのフェブリクによる副作用なのか判断がつきませんでしたが、アロプリノールの副作用を調べてみると、副作用に「白内障」 の記載を見つけて、両目の見え辛さは、白内障であり、その原因は、アロプリノールではないかと、現在でも思っています(2020/04/25)。
フェブリクは大丈夫
当時、このまま、フェブキソスタットを続けていくことについても、白内障に良くないのではないかと懸念がありましたが、フェブリクに関しての副作用情報には、そのような記載はなかったため、フェブリクの服薬は継続することにしました。現在5年が経過しますが、アロプリノールの時のような見え辛さの急激な進行は、ないように思います(2019/11/16)。
その後、2020/03に白内障の治療手術を受けました。記事にもしていますが、よく見えるようになりました。白内障と言われる患部は、2種類あります。それは、水晶体の白濁と水晶体を包む袋(水晶体嚢)の濁りの2つです。僕が気にしていた、アロプリノールやフェブリクの副作用が、どこの部位に作用するのか不明ですが、今回の手術により水晶体に対する副作用の心配は消えました。しかし、水晶体嚢への副作用の懸念は少し持っています(2020/08/17)。
白内障について
ただし、白内障の進行はないと言いましたが、通常の加齢により白内障の症状は徐々に進んでいくものです。両目の見え辛さは、徐々に進んでいるようです(この記述は、白内障の手術をする前までの記録です)。
解説・フェブリク投与ガイド
https://harikiri.diskstation.me/myblog/health/8187/
主治医に相談せず中止
続けてきたフェブリクをやめてみた。2019/5月の健康診断の結果で尿酸値が低い(5程度)事を確認しつつ、6月から20mg錠/日の中止を独断で開始した。
その後、3ヶ月が経過した時点で、主治医に受診して血液検査をお願いした。服用を止めてからから足親指関節の痛みが少し出てきているのを自覚していた。血液検査の結果、やはり、尿酸値は7.0を超えて異常値に戻っていた。フェブリク無しでは尿酸をコントロールすることはできないようだ。
あきらめて、再開
以下の章に示したように尿酸値が高いことは、血糖値の管理と同様に健康上のリスクが高いことを理解しているなら、副作用との折り合いではあるものの尿酸値をコントロールすべきだと思います。結局、私は再開しました。
投薬を開始して4.5年、その期間で、体重を一時期話題になった方法「バターコヒーで減量する」など、当時の体調と比べてダイエットできていたことから尿酸値は上がらないかも、と少し自信がありました。しかし、痩せていても3ヶ月間フェブリクの投薬をやめた後の検査では、尿酸値は上昇していました。その結果から諦めがつきました。主治医も”再開しますか”、私は”はい”、フェブリク投薬を再開することにした。
尿酸値が高いと
よく尿酸値は高いと言う方がいるが、血中の尿酸値が高いと、色々とリスクがある事がわかっているようです。腎結石、尿路結石や慢性腎不全などです。腎臓が悪くなると血中のクレアチニン濃度が増加します。尿量が減っているか、クレアチニンのろ過効率が低下していると考えられます。この状態を長期間続けることは全身的によくないはずです。
高尿酸血症、eヘルスネット[情報提供] より
https://www.e-healthnet.mhlw.go.jp/information/metabolic/m-05-007.html
通風の原理からすると全身に悪影響を及ぼしかねないことは、想像に難くありません。尿酸濃度が高まると、尿酸が結晶化するのですが、その結晶形態は針状結晶 であるため、色々な組織に対してダメージを与え易いと考えられます。
その対象は、傷つきやすく再生が遅い組織であると推定されますが、違う視点からは、硬い組織や、逆に柔らかすぎる組織などです。硬い組織では関節、柔らかい組織では、毛細血管の集合体で且つ緻密な組織構造をしている腎臓、などです。
どんな症状への発症リスクがあるかは、「高尿酸は通風になるだけではない、重要なリスクを抱えている」 をご覧ください。
只今実験中!
実は、若い頃からクレアチニン(Cr)値が高かったのですが、尿酸値が高いこと、それは水分摂取量とに関連がありそうに思っていました。Cr値(男性では女性より高い)から統計的に求められた式を使って計算すると腎臓の濾過能力(GFR)を求めることができます。例えば、男性の場合で、計算結果が、90以上(単位は省略)の場合は正常以上(G1)、60~89は軽度機能低下から正常(G2)、45~59は中程度機能低下から軽度低下(G3a)などがあり、<15は末期腎不全(G5)です。最近、思い付いたことがあり、実行することにしました。血液成分の値はアウトプットと考えると、そのインプットは何なのか? それは摂食や空気です。水分摂取量がCr値に関連しているはずです。以下の記事は、Cr値を下げられる可能性について考察しています。体格と年齢により理想的な水分摂取量を求めることができます。
副作用
アロブリノール は、プリン骨格があり、キサンチンの代わりにXORから分解を受けます 。それによって尿酸合成は阻害されますが、その代わりに違う物質ができることになります。それが副作用を及ぼす原因になってきます。
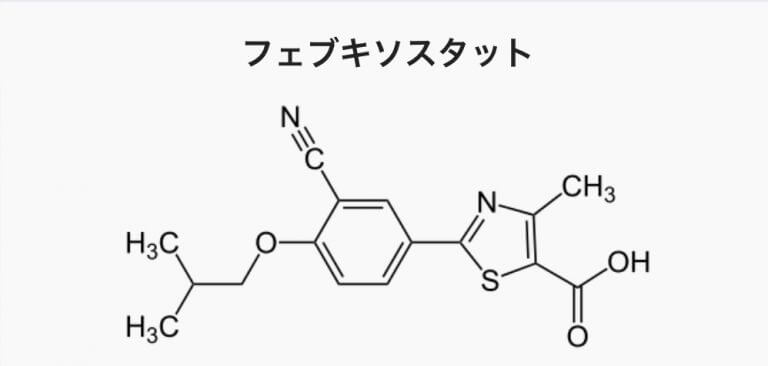
フェブキソスタット は、キサンチンの代わりXORから分解を受けるのではなく、キサンチンを分解するのを邪魔する ことで、尿酸合成を阻害します。そのかわり、キサンチンは分解されずに蓄積していきますが、ヒトではその副作用としての影響はほとんど見られないようです(参考 )。アロブリノールより副作用は少なくなっています。
薬価
薬価サーチサイト KEGG MEDICUS 薬価
フェブキソスタットの薬価
フェブキソスタットは、1品目が薬価掲載されている(KEGGより)
アロプリノールの薬価
アロブリノール は、23品目が薬価掲載されています。いわゆる、「ジェネリック医薬品 」です。ジェネリックであるということは、古い医薬品と言う事です。代表的な3品目を以下の表に示しました (KEGGより)
添付文書
フェブキソスタット添付文書 より
フェブキソスタットの作用機序
キサンチンオキシドリダクターゼ(キサンチン酸化還元酵素)は、細胞内にある余分なプリンヌクレオチドを尿素に分解する。これを阻害することにより、尿酸生成を抑制する。
具体的には、XORにあるキサンチンと結合する反応ボケットにキサンチンの代わりに入り込み、安定的に居座るため、次々とキサンチンを尿酸に酸化する反応が抑制されることになる。
因みに、アロプリノール は、反応ポケットに入り込み酸化反応を受けた後、そのポケットから離れるため、次のアロプリノール(もしくは、キサンチンの可能性もある)が反応ポケットにはいるという反応が続く。
フェブリクの非臨床試験
非臨床試験の概括評価 2.4.2.2.4 キサンチン結石形成に関する評価pmdaより
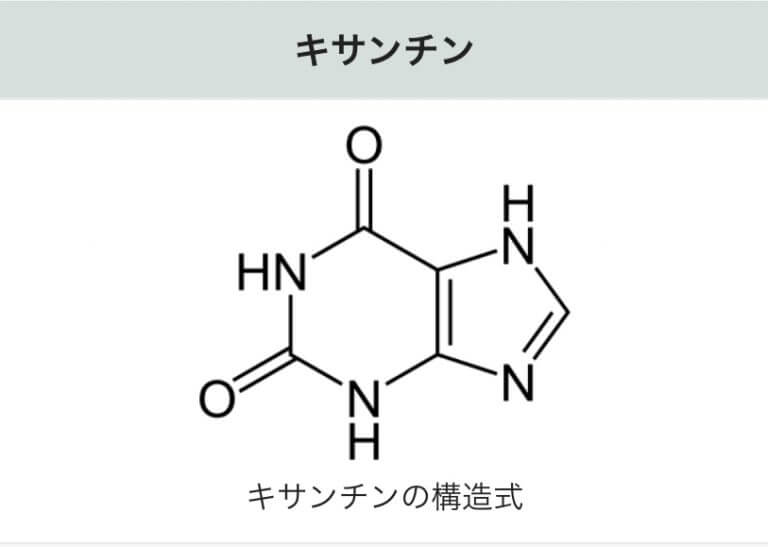
キサンチンは、水に難容性で、同様に血液中でも溶けにくく、特に濃度が高くなると腎臓で結石を生じる。
XORの活性阻害によりキサンチンの蓄積が生じるが、動物実験から、ヒトでの用法容量の範囲内では、その副作用は気分けて起こりにくい。
蓄積するキサンチンは、サルベージ回路は無いものの尿排泄がある。ヒトでは、動物に比べて尿量が多いためキサンチン蓄積は抑制的である。
フェブリク は、他の主要なプリン・ピリミジン代謝酵素の活性に影響を及ぼさず、キサンチンオキシダーゼ を選択的に阻害する
論文
作用機序の理解 のために、以下に、技術論文からそれぞれ紹介しました。理解の助けになると思います。
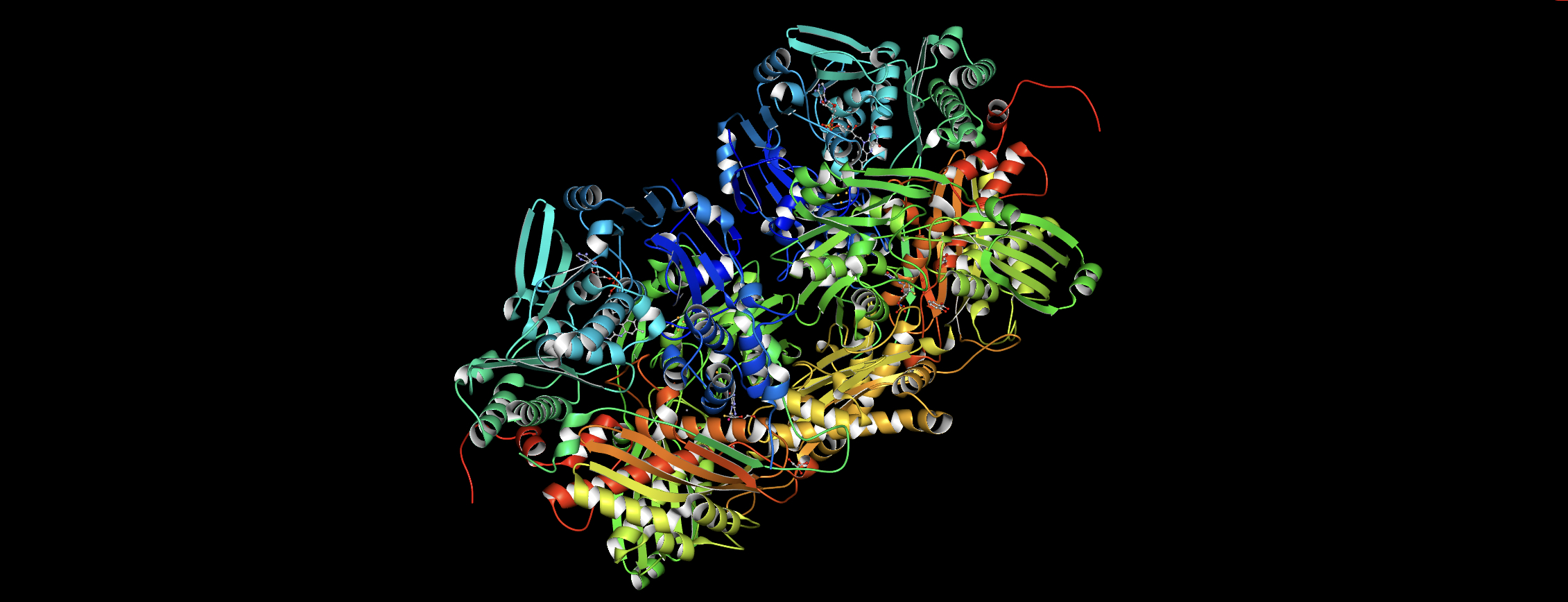
フェブリクが抑える酵素(XOR)の立体構造 (3D )
その酵素は、尿酸を作り出す「XOR 」
XORの基質 (結合できる物質)が薬(フェブキソスタット、アロプリノール)になる
関連する代謝経路 、尿酸 は、最終産物である
XORの立体構造
3D立体構造
図1. 牛ミルク由来、キサンチンオキシドリダクターゼの分子構造(リボン表示) 尿素合成酵素と尿素分解酵素
ヒトの高尿酸血漿の治療に最も重要な尿酸分解酵素は、キサンチン酸化分解酵素(キサンチンオキシドリダクターゼ; XOR 、分子2分子からなる分子量294kDa)である。
因みに、一般的に酵素の分子量は大きく、免疫反応に関わるインターフェロンやサイトカインは、それと比べ分子量は1/10程度と小さい。
金属のモリブデン、硫化鉄が結合する比較的大きなタンパク質である。
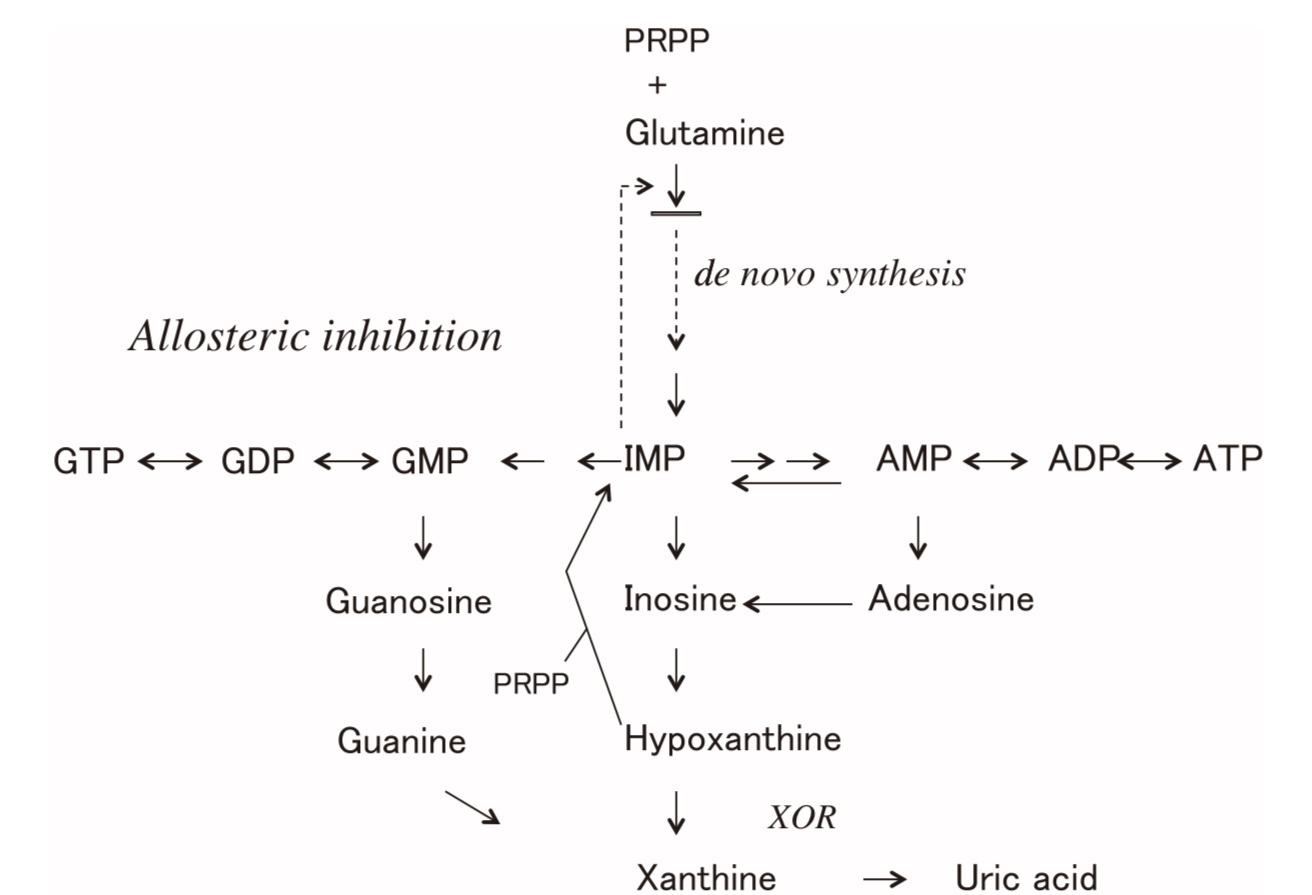
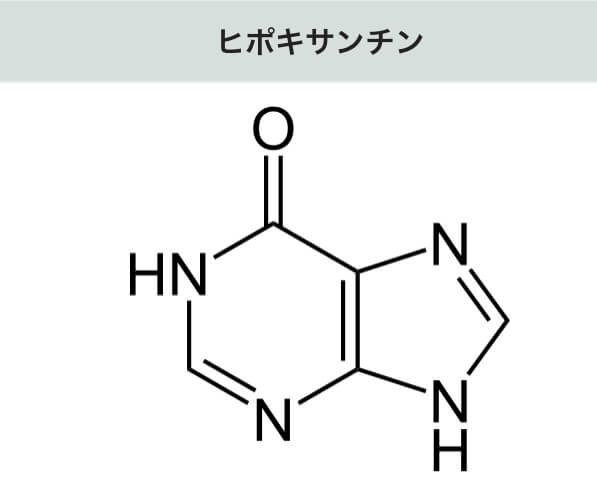
XORがハイポキサンチンを酸化してキサンチンを作る。更にキサンチンを酸化して尿酸を作る。キサンチンはいくつかの代謝系の合成経路で作られる(図3 )。
アデニンヌクレオチド代謝系(AMP,ADP, ATP)
グアニンヌクレオチド代謝系(GMP, GDP, GTP)
上記2つの中間に位置するIMP経路
生体内の代謝経路
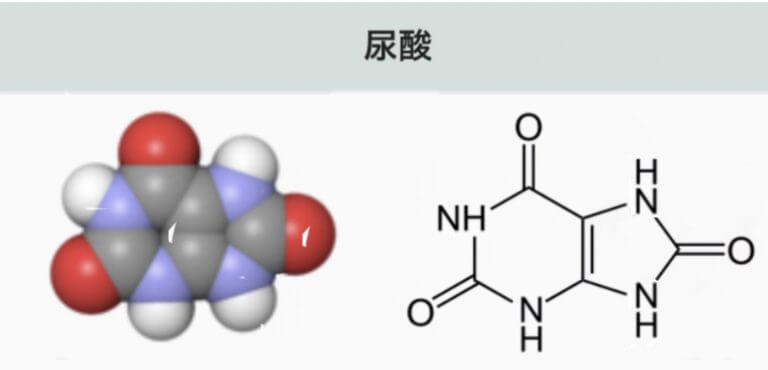
尿酸(Uric acid)は、生体内における最終産物です。その前駆体のキサンチン(Xanthine)、および更にその前駆体のハイポキサンチン(Hypoxanthine)は、XORによって尿酸に分解(合成)されます。その後、尿として体外に排出されます。フェブリクは、XORによる尿酸の合成を阻害する医薬品です 。
無酸素運動などで「ヒポキサンチン (hypoxanthine)
代謝するためには、酵素「XOR」が働き、「キサンチン (xanthine)
キサンチンは、最終産物である「尿酸 (Uric acid)
尿酸は、「腎臓」でろ過され「尿 」という排泄集合体として排泄される
図3. プリンの主な代謝反応経路 XORの基質となる物質の構造式
ヒポキサンチンがXORによって酸化されキサンチンになる (ウィキペディアより)
尿酸
ヒトにおいてXORは唯一、尿酸を合成する酵素である。ヒト以外では、更に溶解性が高くて排泄され易い分子にまで尿酸を分解する有効な酵素をもっているとのこと。しかし、ヒトでは尿酸を更に分解する酵素活性が、進化の過程で低くなったらしく、長寿化に役立つ抗酸化物質としての尿酸の分解を抑制して、高濃度を保つようなった可能性も指摘されている。
XOR、すなわちキサンチン酸化還元酵素は、名前が示すように酸化酵素(oxidase)であったり、還元酵素(reductase)であったりする。微生物から哺乳類の高等動物に及び維持されたアミノ酸配列で保有している。
因みに、還元酵素は脱水素酵素ともいう。分子状態の酸素を基質(この酵素が作用したい目的の物質のこと)としており、酸素に、水素を受容(くっつける;H2O←2H+ + O2-)させる。あるいは、電子を受容(くっつける、すなわち水素を外す; 例えば、H2 O→2H+ + O2- ; 活性酸素の発生)させる。
酵素中のSS結合が維持されている場合、あるいは、分解酵素で分解されれば常時、酸化酵素型になる。SS結合が切断(還元)されると還元酵素になる
まとめ
10年以上(30才後半)も前から足の親指の付け根関節痛がありました。ウェイトトレーニングをしていること、高タンパク質を摂取していたことは、一つの要因ですが、若い頃から尿酸値は6以上 ありました。
痛風薬服用のきっかけは、痛風の発作からではなく、手指の関節(中指を中心に全部の指)の「鈍痛」と、「尿酸値」の上昇(8超)の2つをきっかけ にアロプリノールの服用を開始しました。その後、白内障の心配もありましたが、フェブキソスタットに切り替えて約5年の服用を続けています。
ネットでは、心臓関連のリスク について見つけた事をきっかけに、自己判断で3ヶ月間の服用の中止 を行いました。その後、その服用中止の影響を知るために、血液検査を受けました。
その結果、やはり、血中の尿酸値は、中止前で「5」でしたが、中止後3ヶ月後で「7」を超え ていました。併せて、足の親指付け根の関節の「鈍痛」も出てきていました。
再度、ネットからフェブキソスタットの心筋関連のリスクについて調べた結果、心筋関連の持病がなければ、悪影響を受けるリスクはそれほど高くない ことを理解しました。
尿酸値が高いことは、腎機能の低下に繋がる言葉エビデンスがあります。今の年齢に応じたQOLの維持と腎機能の低下リスク を考えた時、フェブキソスタットの服用を再開することにしました。
以上
参考文献
キサンチン酸化還元酵素 -物理学から臨床医学まで – 2017より117: キサンチン酸化還元酵素(Xanthine Oxidoreductase) よりキサンチン酸化還元酵素の構造とプリン水酸化反応機構 モリブデンによる水酸化反応中間体の構造と反応機構 日本発の「抗痛風剤のルネッサンス 非臨床試験の概括評価 2.4.2.2.4 キサンチン結石形成に関する評価pmdaよりWiki Pediaより
ベンズプロマロン: 尿細管における尿酸の再吸収阻害剤、添付文書
編集履歴
2019/09/08、追記
2019/11/15、文言整備
2019/11/16、新血管疾患既往患者での死亡率とそのリスクの考え方、アロブリノールの副作用、について追記
2019/11/18、結論を冒頭に追記
2019/12/20、作用機序、阻害する対象の酵素について追記
2019/12/22、アロブリノールによる霞目は、5年で改善したについて追記
2019/12/30、キサンチン蓄積はヒトでは問題にならないことを追記
2020/01/13、文言整備
2020/02/01、高尿酸血症であるとかかり易い病気を追加(eヘルスネットより)
2020/04/25、文言整備、追記 (白内障の記載を縮小、白内障手術を3月に受けたため、記事内容を移動したことによる)
2020/05/07、追記 (まとめ、関連記事)
2020/08/17、追記 (白内障治療した体験記事をリンク)
2020/08/22、文言整備、追加(検索結果に表示される説明)
2020/10/03、文言整備 (ヒポキサンチンから尿酸までの分解・排泄の説明)
2020/12/12、追記 (投薬のきっかけは、手指の関節痛が出た時)
2021/06/27,追記(Crについて)
2022/10/02,追記:適正水分摂取量についてヘルスハックしているはりきり(Mr)記事へのリンクを追加
2022/11/18,追記:最初のところは,少し唐突な始まりになっていたので,前説を挿入しました.
![気になる企業 – Sartorius stedim biotech & cellca – ID6309 [2020/01/07]](https://harikiri.diskstation.me/myblog/wp-content/uploads/2019/10/B4F24978-42E9-477E-92B0-94605AEBEAB4.jpeg)
![[Life] 正月の休み最後の日、八尾LINOASのTSUTAYA & STARBUCKSにて [2020/01/05]](https://harikiri.diskstation.me/myblog/wp-content/uploads/2020/01/3C509C17-1CCA-46E0-A051-0079433DBD79-1200x1200.jpeg)








![[Life] ホテル阪急エキスポ、お正月バイキング・ファイナルに行ってきました – ID5679 [2020/01/04]](https://harikiri.diskstation.me/myblog/wp-content/uploads/2020/01/DCB7A588-DAFB-448F-A773-0C7D7AFDC4AA-1200x838.jpeg)



























































![[Life] 2020 – 初外食は中華 – ID5304 [2020/01/02]](https://harikiri.diskstation.me/myblog/wp-content/uploads/2020/01/15DFD268-5716-472A-84A5-FA278600D63B-1200x1200.jpeg)











![[Life] 2020 謹賀新年(令和2年) by はりきり(Mr) [2020/01/01]](https://harikiri.diskstation.me/myblog/wp-content/uploads/2020/01/B0D4AC96-21AB-4F2B-A24E-9AAD1913178E.jpeg)

![[健康] フェブリク投薬、そろそろやめたい – 血糖値の管理と同様に尿酸値の管理は、健康管理上避けてはいけない〜服薬患者による自己実験記 – 僕は続ける[2020/08/22]](https://harikiri.diskstation.me/myblog/wp-content/uploads/2019/12/E908708D-A38F-4933-8FB2-1DB4448DD633.jpeg)

![[食] 2019年、いきなりステーキ食べ納め – ID5180 [2019/12/31]](https://harikiri.diskstation.me/myblog/wp-content/uploads/2019/12/58E1DA09-552C-465F-80A2-79CF5267B4F0-1200x900.jpeg)


















![[健康] アスタキサンチン – 抗酸化作用はビタミンCの6000倍 – むしろ、リン脂質の過酸化抑制が強いことが特徴 – ID5098 [2019/12/31]](https://harikiri.diskstation.me/myblog/wp-content/uploads/2021/02/80F3D755-3019-49C6-BDAE-47D137C87826.jpeg)
![[健康] キサンチン – 体内における代謝 : キサンチン → 尿酸 – フェブリクの薬効原理を少しだけ学ぶ – ID5111 [2021/11/09]](https://harikiri.diskstation.me/myblog/wp-content/uploads/2019/12/7ABE861A-6169-4B9F-B08F-7A2B11D155C9.jpeg)