Key Considerations in Gene Therapy Manufacturing for Commercialization, 2018 – Cell Culture DISH
(1) Phase 1 Clinical Study: 18 month (breakthrough), Several months (Traditional BLA)
(2) Decision on BT Application: – (BT), N/A (TD)
(3) EOP 1 Meeting Confirms BT Therapy Study: 6 months (BT), N/A (TD)
(4) Phase 2/3 Clinical Study: 24 months (BT), P2:Several Mo. to 2y and P3:1 to 4y (TD)
(5) EOP 3/Pre-NDA/Pre-BLA Submission Meeting: -, –
(6) NDA/BLA Preparation: 6months(BT), – (TD)
(7) NDA/BLA Review: 6months(BT), 10months(TD)
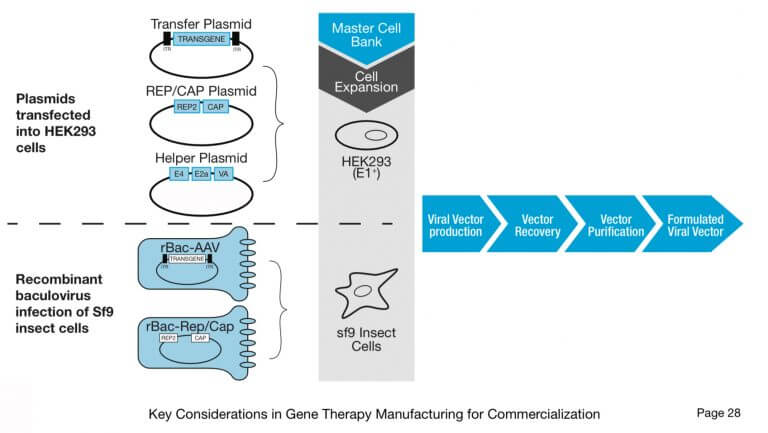
(8) Development Timeline: ~5.2y (BT), ~7.4y(TD)・Plasmid Manufacturing : Fermentation→Plasmid Recovery→Purification→Fromulatiion→(Transfect)
・Viral Manufacturing: Expand→(Transfect)→Clarification→Concentration→Purifiation→Sterilization→(Activate & Modify)
・Cell Processing: Isolate & Enrich→(Activate & Modify)→Expand→Harvest→Formulation
Viruses used: Retrovirus, Lentivirus, AAV and Adenovirus.iCELLis Nano, 500の情報、Allegro single use bioreactor
DSP platform : 3 chromatography system.
Transfection System
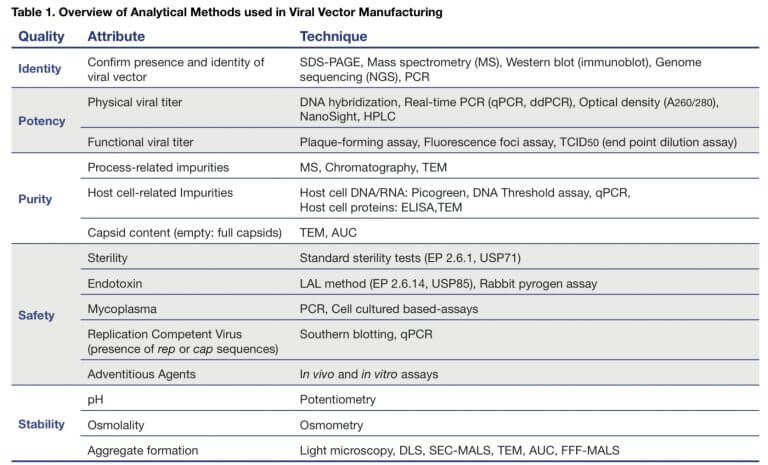
Analytical Method
https://cellculturedish.com/wp-content/uploads/2018/09/Key-Considerations-Gen-Therapy-Manufacturing-Commercialization.pdf
Methods Matter — Standard Production Platforms For Recombinant AAV Can Produce Chemically And Functionally Distinct Vectors, 2019 –
https://www.biorxiv.org/content/10.1101/640169v2.full.pdf
Pharmacology of Recombinant Adeno-associated Virus Production, 2018 – mol Ther Methods Clin Dev. 2018 Mar 16; 8: 166-180 –
ベクターが大きいとFull率は低下する。トリプル-インフェクションでは、更にfull率は低下する。
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5908265/
rAAV2-FIX vectors in A549-derived producer cell line
(1) full particels : 8%~13%
rAAV2 vectors inHEK293 cells
(1) full particles : up to 74% for a 3.4kb-vector, 40%~45% for a 4.2kb-vector
(2) full particles: 8% and 10%~12% by triple-transfection
Manufacturing of viral vectors for gene therapy: part I. Upstream processing, 2014 – Pharmaceutical BIOPROCESSING –
https://www.openaccessjournals.com/articles/manufacturing-of-viral-vectors-for-gene-therapy-part-i-upstream-processing.pdf
Pharmacology of Recombinant Adeno-associated Virus Production, 2018
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5908265/
In Vitro Packaging of Adeno-Associated Virus DNA ,1998
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC109794/
Next-generation AAV vectors—do not judge a virus (only) by its cover , 2019, AviGen GmbH source – ベクター開発、発現制御、プロモーター
CATAPULT, UKにおける遺伝子治療、Cell Therapy, Viral Vectors, 製造・分析、クリニカル、Webinar開催など、網羅的に関係する情報の宝庫 soruce
Enhancement of Adeno-Associated Virus Infection by Mobilizing Capsids into and Out of the Nucleolus
, (2009) AAV2の感染時、核小体への導入効率の向上薬剤(MG132とHU)
Scalable Production of AAV Vectors in Orbitally Shaken HEK293 Cells (2019)
特許公報(B2)_アデノ随伴ウイルス(AAV)血清型9の配列、それを含むベクターおよびその使用、配列が特許になっている。
特許公報(B2)_アデノ随伴ウイルス(AAV)血清型8の配列
AAVベクターの製造・品質に関するリフレクションペーパー (pmda
https://www.pmda.go.jp/files/000221591.pdf
平成29年度我が国におけるデータ駆動型社会に係る基盤整備 「根本治療の実現」に向けた適切な支援のあり方の調査
https://www.meti.go.jp/meti_lib/report/H29FY/000111.pdf
遺伝子組換え生物に係る
法規制の動向について
独立行政法人製品評価技術基盤機構 バイオテクノロジーセンター (Biological Resource Center, NITE ; NBRC)
https://www.kansai.meti.go.jp/2-4bio/kansai_smartcell/180925_4.pdf
バイオ戦略の策定に向けた検討
バイオテクノロジーによるイノベーションを通じて実現を目指す 経済社会像(ビジョン)
https://www8.cao.go.jp/cstp/tyousakai/bio/1kai/siryo4.pdf
遺伝子治療とゲノム編集治療の 研究開発の現状と課題
Since 1874
https://www.kantei.go.jp/jp/singi/kenkouiryou/genome/advisory_board/dai4/siryou4-1.pdf
ウイルスを基盤とした遺伝子治療薬の臨床開発の
現状と今後の展望
https://www.jstage.jst.go.jp/article/dds/34/2/34_99/_pdf/-char/ja
ex vivo遺伝子治療用製品の品質管理戦略の留意点
Points to consider on quality control strategy for ex vivo gene therapy products
http://jsgt.jp/CLINICAL_STUDY/2018-1pmda.pdf
脳卒中に対する遺伝子治療の現状と将来
http://cbfm.mtpro.jp/journal2/contents/assets/016030167.pdf
AAV を利用した遺伝子治療
小 澤 敬 也
http://jsv.umin.jp/journal/v57-1pdf/virus57-1_047-056.pdf
アデノ随伴ウイルス(AAV)ベクターによる遺伝子治療 (2003)
AAP (Assembly Activating Proteins)
科学研究費助成事業 研究成果報告書
適正製造規範に適合する簡易精製が可能な次世代AAVベクターの開発
PMDA
厚生労働省精神・神経疾患研究委託費
病原体検出マニュアル (国立感染実用研究所)