タグ: stability
-
Exosome – エキソソーム医薬品開発の歴史と今後のコマーシャル製造に向けた課題となる安定化剤についてAIに聞いてみた! [2025/05/16]
Post Views: 85 はじめに Exosome医薬品の開発の歴史についてAIに聞いてみた.1980年代…
投稿者

-
[Bio-rAAV] AAVカプシド蛋白質VP1のpH依存的な構造変化 – エンドソーム脱出につながっているのか – ID8476 [2020/02/02]
Post Views: 619 VP1の機能 カプシド蛋白質VP1の領域のうち、pH酸性(4-6)により内部に…
投稿者

-
[Bio-AAV] AAVカプシド蛋白質のpH依存的な分解性について-論文紹介 (2012) – ID8474 [2020/02/02]
Post Views: 672 要約 (Goolge翻訳より) 高度に精製されたアデノ随伴ウイルス(AAV)キ…
投稿者

-
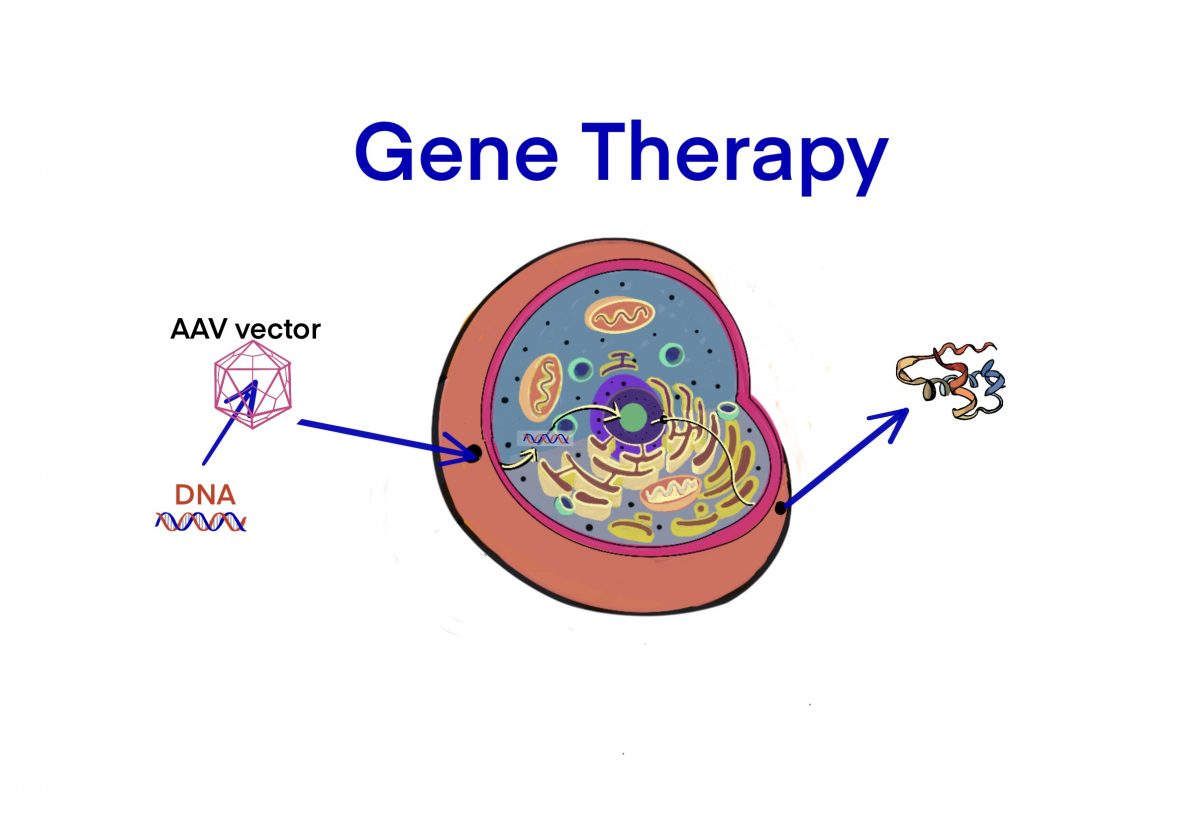
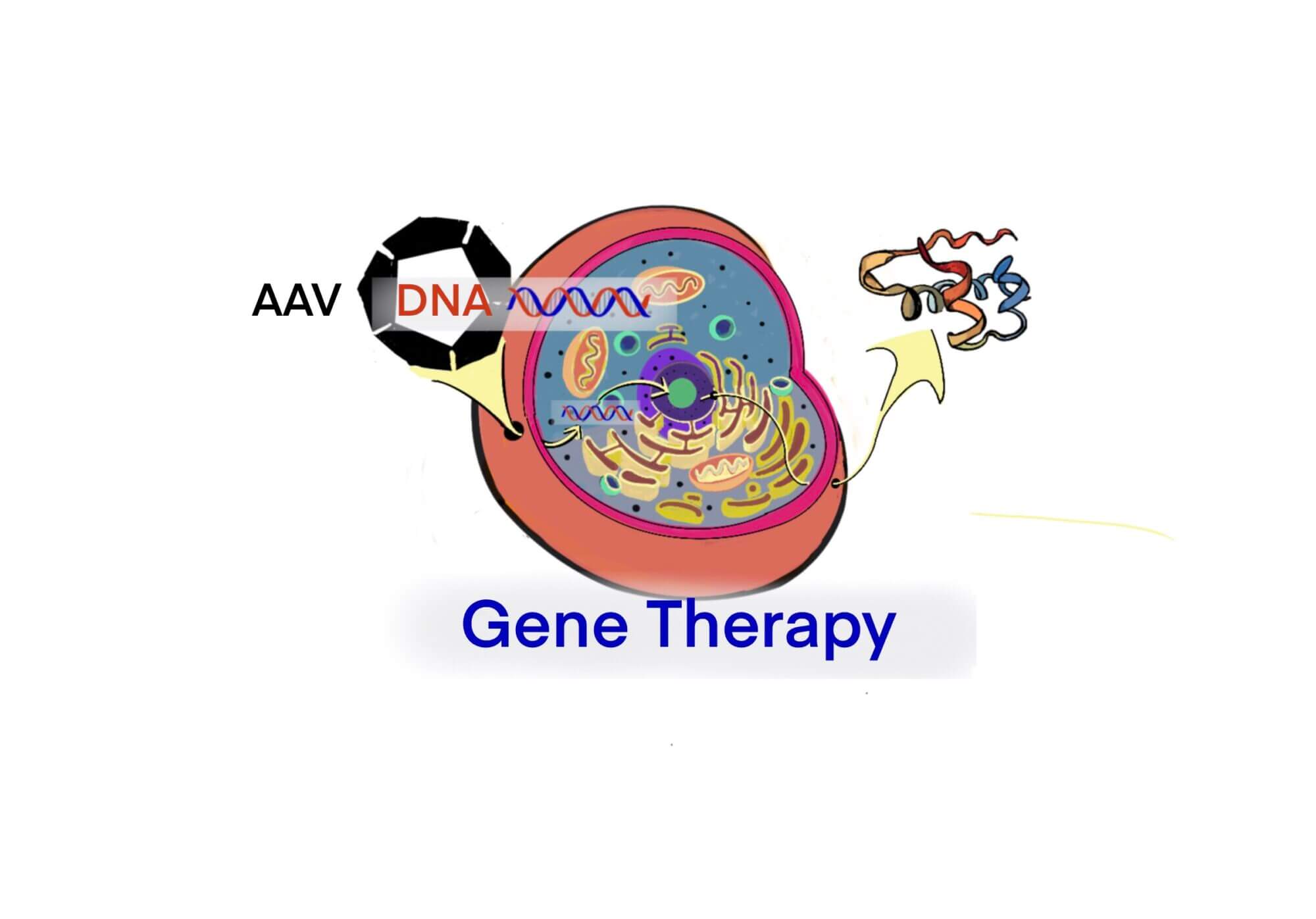
[Bio-Edu] AAV およびrAAV vector について- 長所/短所、立体構造、分子量および血中半減期 及び他ベクターとの比較[2020/11/05]
Post Views: 658 はじめに 遺伝子治療用に使用されるウイルスベクターには、AAVの他にLenti…
投稿者