タグ: precipitation
-
[Bio-Edu] タンパク質の「イオン交換体」による精製原理 – 目的タンパク質の物性を知る必要性 [2021/02/25]
Post Views: 794 はじめに タンパク質の精製とは、どのような作業をするのでしょうか? 精製とは目…
投稿者

-
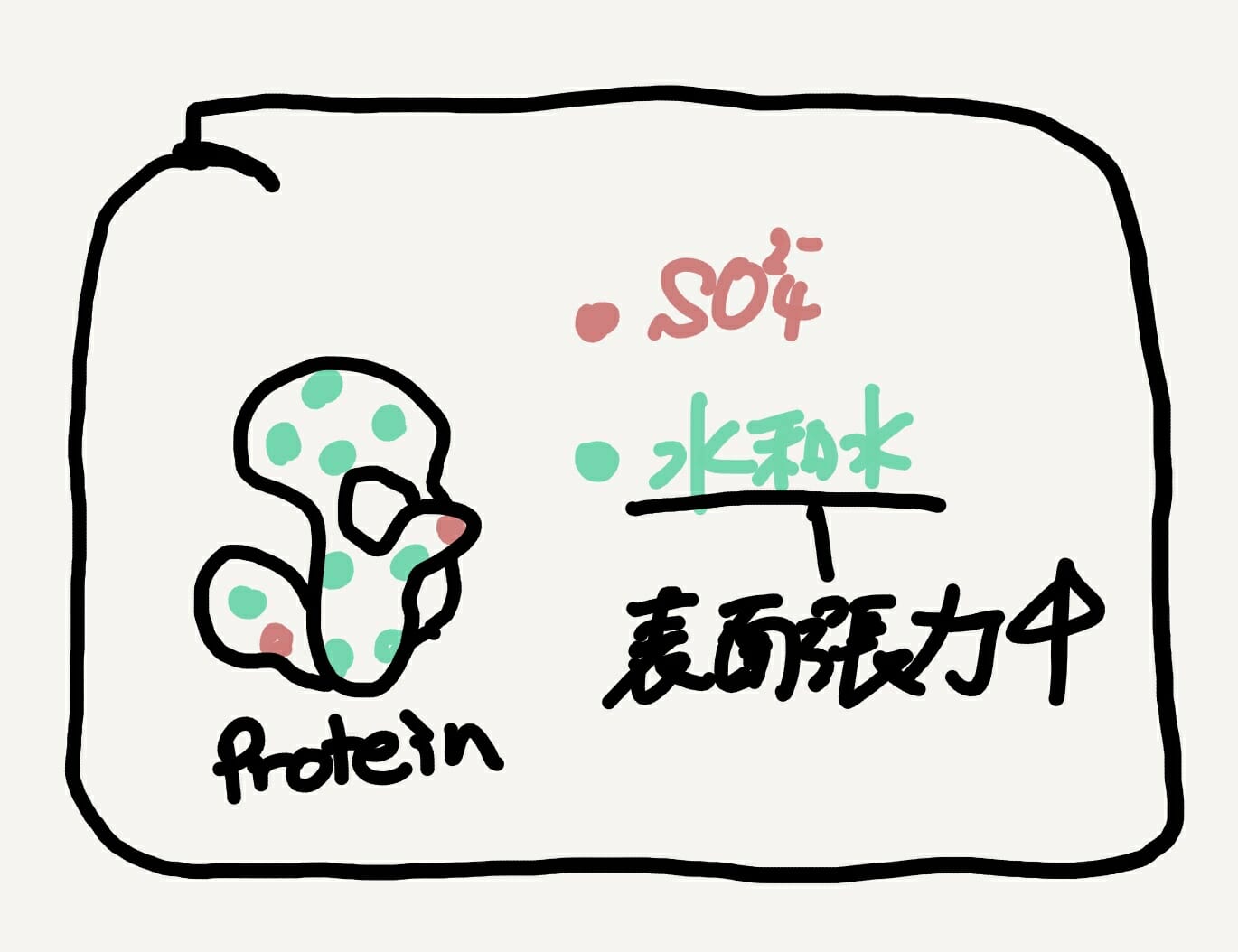
[Bio-Edu] 沈殿化法によるタンパク質の回収・分離 – 検討方法 – ID4376 [2025/04/21]
Post Views: 965 はじめに Ribonuclease Aのアセントン沈殿の条件検討につい、学生さ…
投稿者

-
[Data Link] rAAV vectorの沈殿法を使った精製方法に関する文献のリンク – ID745
Post Views: 364 文献情報のみ A simplified purification method…
投稿者