タグ: drug
-
医薬品製造 – 製造設備・装置の除染作業の能力検査にはBio Indicatorが使用される.
Post Views: 549 Bio Indicatorとは, (以下は,Copilotも活用してまとめた内…
投稿者

-
[用語] NDA ; New Drug Application; 新薬承認申請 [2020/12/16]
Post Views: 1,037 NDA ; New Drug Application; 新薬承認申請 (米…
投稿者

-
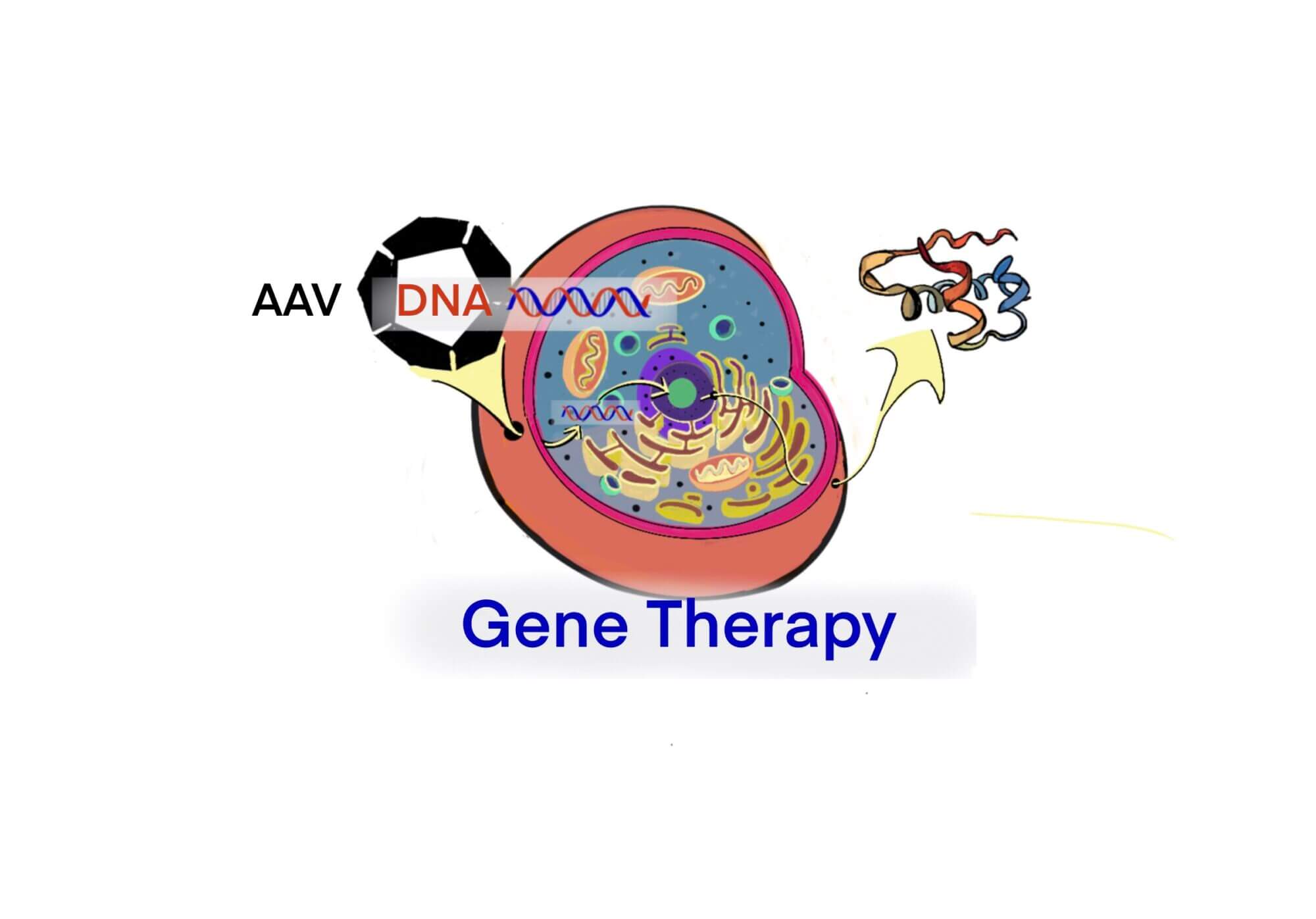
[遺伝子治療薬] ZOLGENSMA – AveXis-Novartis社が開発した筋萎縮性側索硬化症 (SMA)治療薬 – SM [2020/07/27]
Post Views: 1,074 筋萎縮性側索硬化症 筋萎縮性側索硬化症(Spinal Muscular A…
投稿者

-
[遺伝子治療薬] ZOLGENSMA – スイスのノバルティス社(AveXis)が開発した遺伝子治療薬 [2020/06/22]
Post Views: 987 ZOLGENESMA スイスのノバルティス社(売上高約500億ドル, Inve…
投稿者

-
[Bio-Edu] BiTE抗体 – 6 x His tagで精製を容易にする [2020/07/27]
Post Views: 501 BiTE抗体とは 二重特異性抗体(BiTE)は、がん細胞と免疫細胞を引き合わせ…
投稿者

-
[GT] 世界で承認された細胞・遺伝子治療薬 – ID1872 [2019/09/06]
Post Views: 339 遺伝子治療薬リスト(2017) 2017年に経済産業省がまとめた、世界で承認さ…
投稿者