タグ: AAV2
-
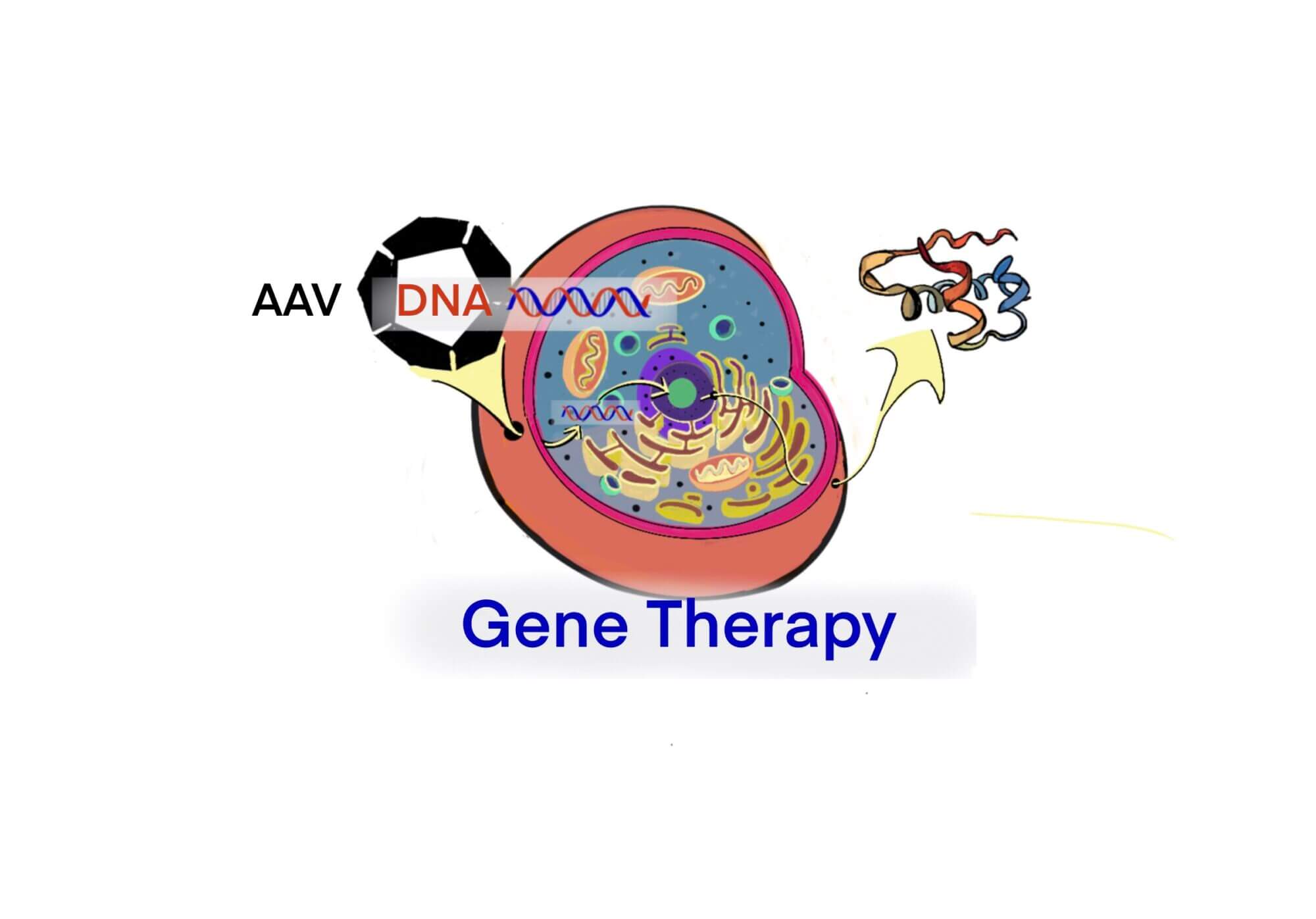
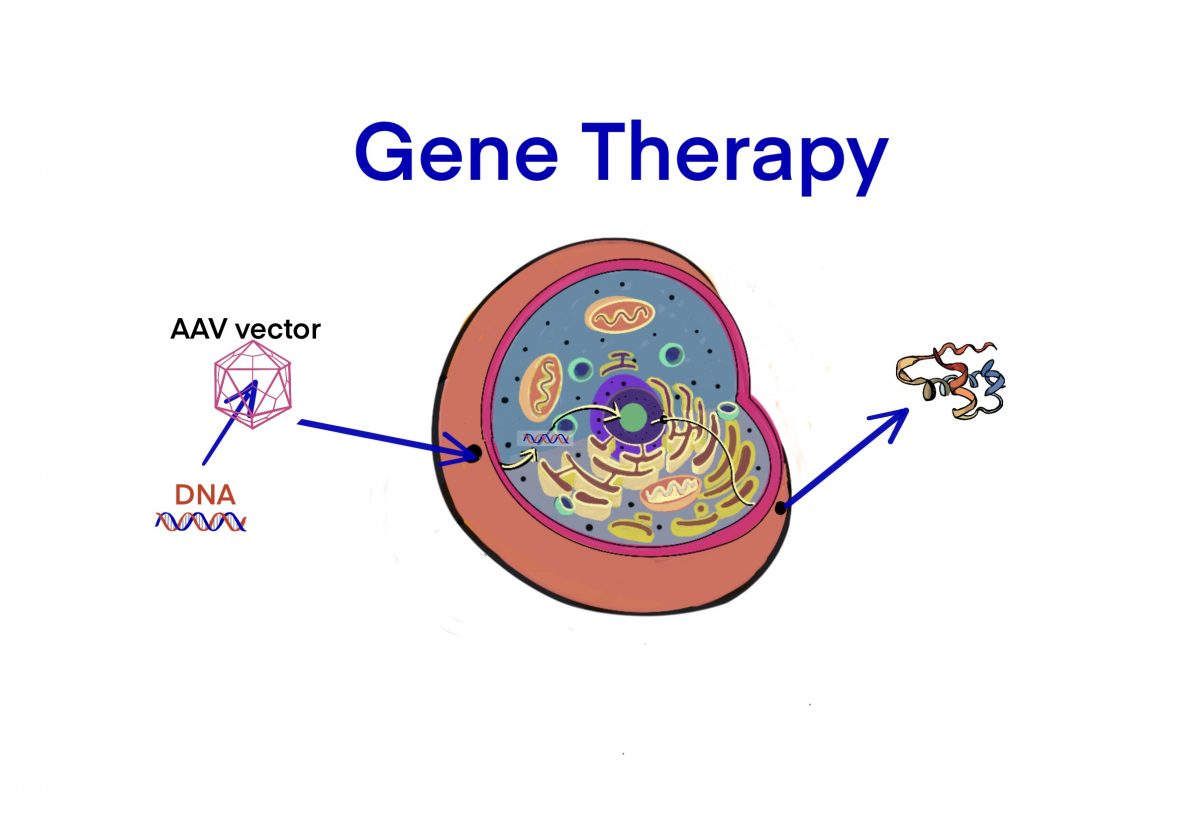
[rAAV] Parvovirusに属するアデノ随伴ウイルス(AAV)をベクター(rAAV)にして遺伝子治療を行う — rAAVの特徴と臨床 (2003) – ID2516 [2019/10/02]
Post Views: 617 AAVベクター Adeno associated virus (AAV) ベク…
投稿者

-
[Bio-Edu] AAV2の感染に関わるレセプターは何か? – ID18442 [2019/07/20]
Post Views: 873 レセプターを考えるとき 生体内の物資が、特定の組織に収束するのは、受容体(re…
投稿者