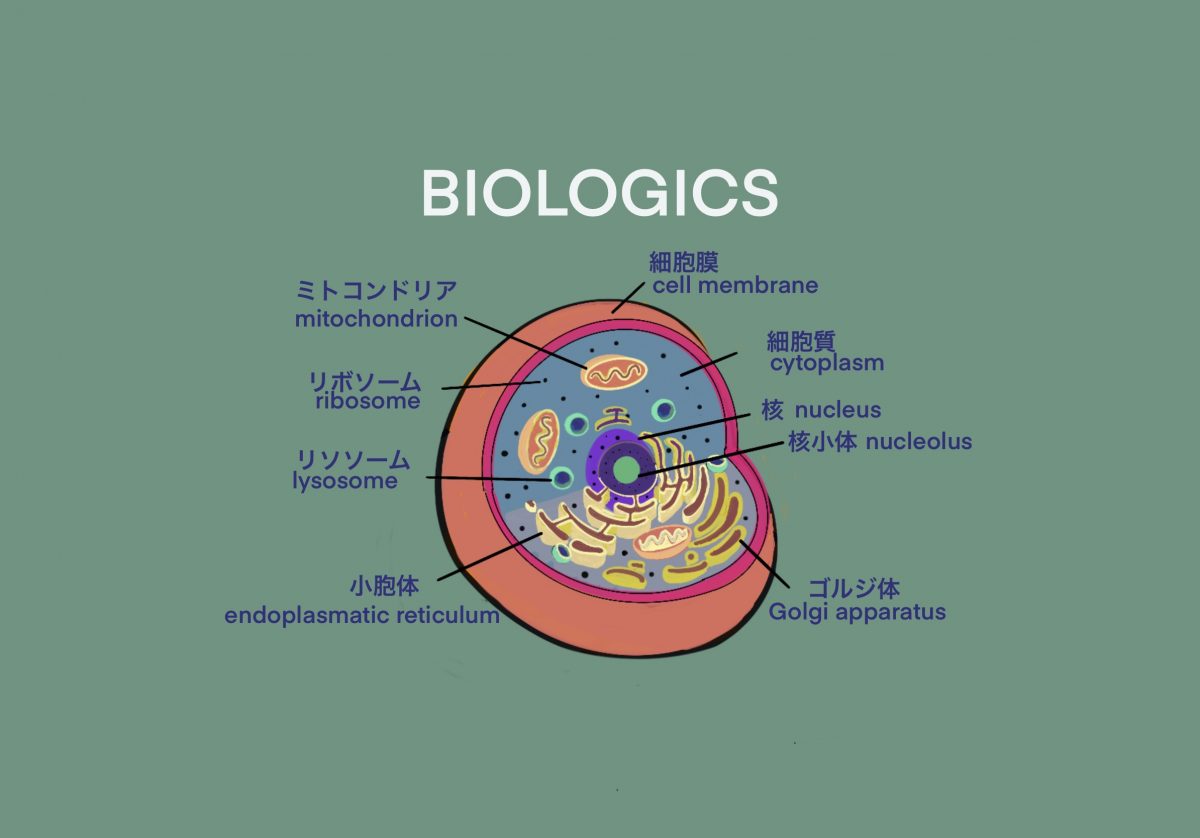
カテゴリー: BIOLOGICS
-
[Data Link] FDA DRUG APPROVAL LIST 2019 – ID6607 [2020/01/09]
Post Views: 524 FDAで承認されたすべての医薬品について,モダリティー毎に詳細を見ることができ…
投稿者

-
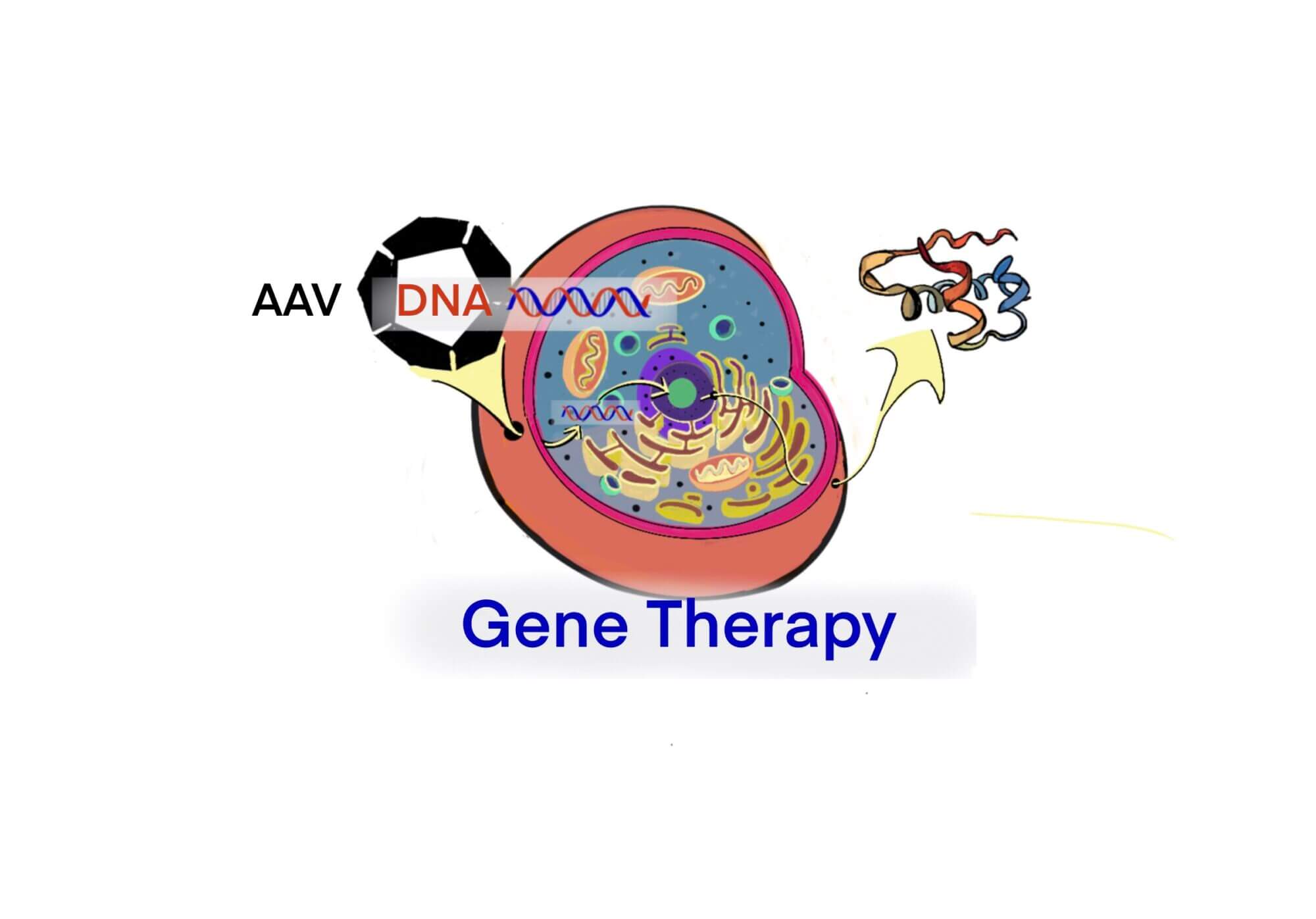
[GT] 遺伝子治療の課題 – H30, 経済産業省より – ID2031 [2020/01/08]
Post Views: 374 2019現在における遺伝子治療薬の製造課題 Full particleとEmp…
投稿者

-
[Bio-Edu] 腫瘍溶解性ウイルスによる治療薬の開発 (タカラバイオ) – ID3358 [2020/01/08]
Post Views: 430 C-REVは単純ヘルペスウイルス1型(HSV-1)を弱毒化した腫瘍溶解性ウイル…
投稿者

-
[Data Link] AAV-3Bのキャラクタ – 文献レビュー – ID3151 [2020/01/08]
Post Views: 466 AAV血清型3 細胞に感染する時、ヘパラン硫酸プロテオグリカンに結合 AAV-…
投稿者

-
気になる企業 – Vigene Biosciences – GMP準拠のPLCサービス – ID3756 [2020/12/22]
Post Views: 508 Vigene Home Page : Vigene Biosciences 下…
投稿者

-
気になる企業 – Sartorius stedim biotech & cellca – ID6309 [2020/01/07]
Post Views: 550 Sartorius stedim biotech GMP製造などで海外企業の製…
投稿者

-
気になる企業 新日本科学(SNBL) – 日本のCRO – ID5076 [2019/12/29]
Post Views: 547 新日本科学 新日本科学は、1957年に創業した、わが国初の医薬品開発受託研究機…
投稿者

-
[Bio-Material] 一過性発現 – 品質・生産性とも安定発現株に迫る – Gibco ExpiCHO Expression System (ThermoFisher) – ID5031 [2019/12/27]
Post Views: 563 ExpiCHO Expression System 製造株は、CHO細胞を前提…
投稿者

-
気になる企業 – Omeros – 頑張るベンチャーの1つの戦略を垣間見る – ID4832 [2020/08/11]
USナスダック上場のOMEROSは、従業員250名程度のベンチャー企業。先ずは、低分子医薬品で市場に進出し、現…
投稿者

-
[Bio-Edu] 細胞調製施設のグレードとは (レジメ) – ID3172 [2019/12/21]
Post Views: 459 考慮事項 H25/12/24 第8回細胞組織加工製品専門部会資料 –…
投稿者