カテゴリー: BIOLOGICS
-
[rAAV] 製剤組成 – rAAV8の製剤組成 – 特許文献から – ID7881 [2020/01/23]
Post Views: 620 優先権: US 公開特許公報(A) 2019-537578 公開日 2020/…
投稿者

-
[用語] CMO; Contract Manufacturing Organization
Post Views: 566 Contract Manufacturing Organization 医薬品…
投稿者

-
[用語] CDMO : Contract Development Manufacturing Organization
Post Views: 580 CDMO: Contract Development Manufacturin…
投稿者

-
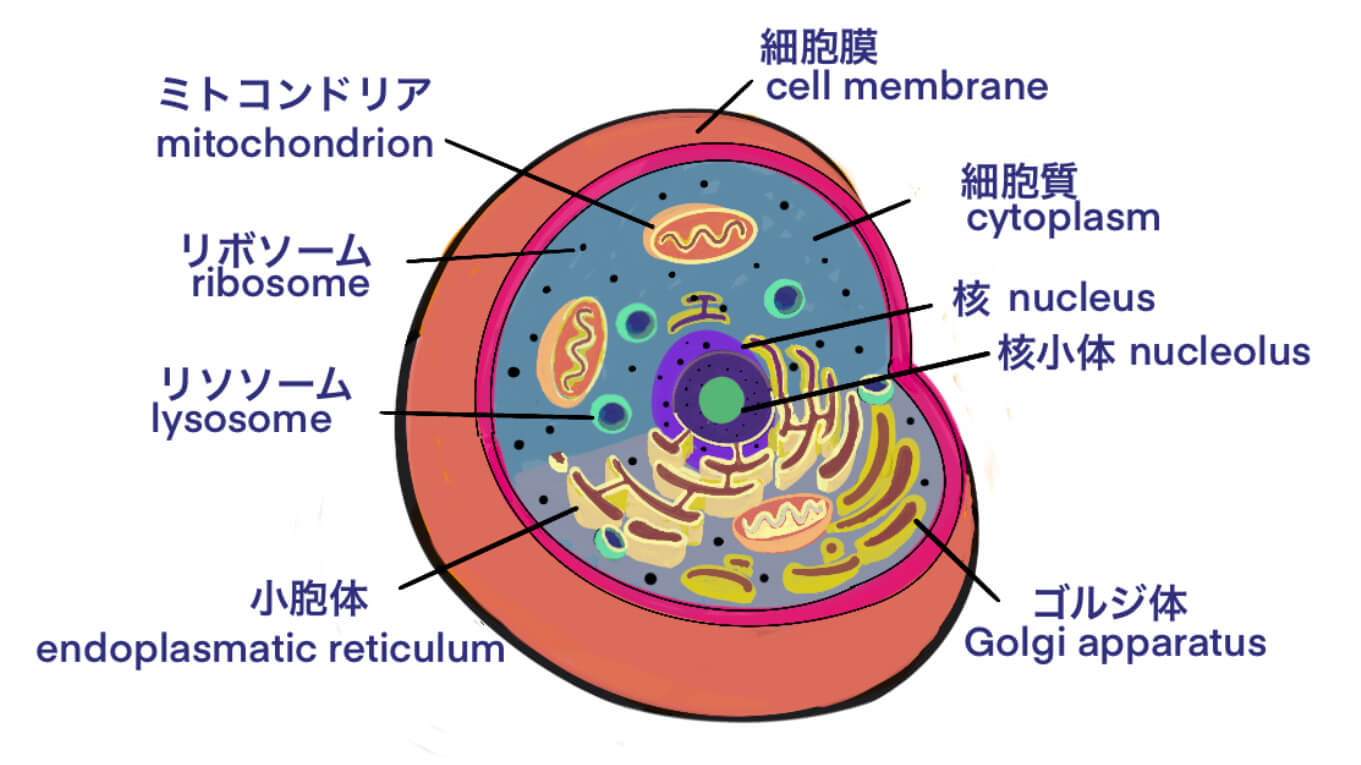
[用語] HEK細胞 ; ヘックさいぼう – バイオ医薬品で用いられる生産用宿主細胞
Post Views: 600 HEK 細胞 ; human embryonic kidney cell 詳し…
投稿者

-
[用語] GOI ; Gene of interest ; 目的遺伝子 – 遺伝子治療薬開発用語
Post Views: 644 GOI ; Gene of interest 目的遺伝子。遺伝子治療薬開発にお…
投稿者

-
[用語] codon ; コドン – 遺伝子の構成要素はA,T,G,C、アミノ酸は3つの組み合わせ
Post Views: 609 codon コドン(英: codon)とは、核酸の塩基配列が、タンパ…
投稿者

-
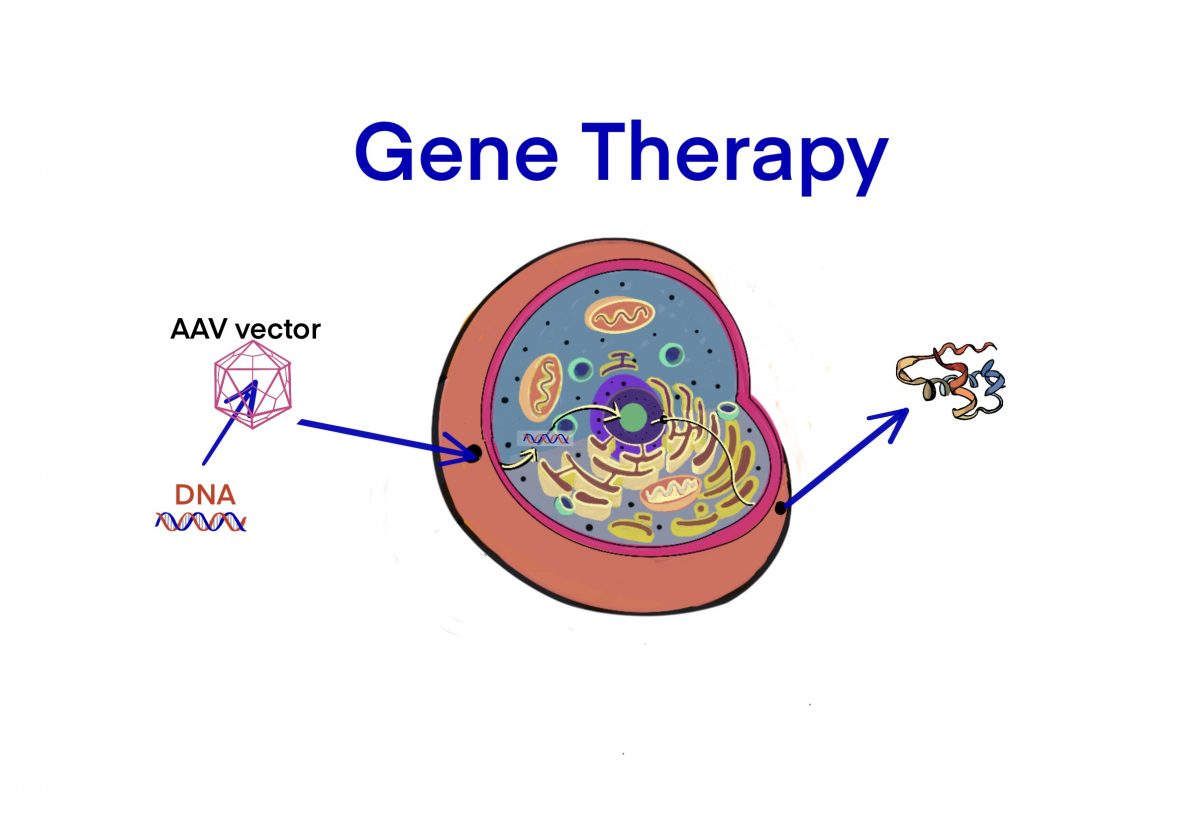
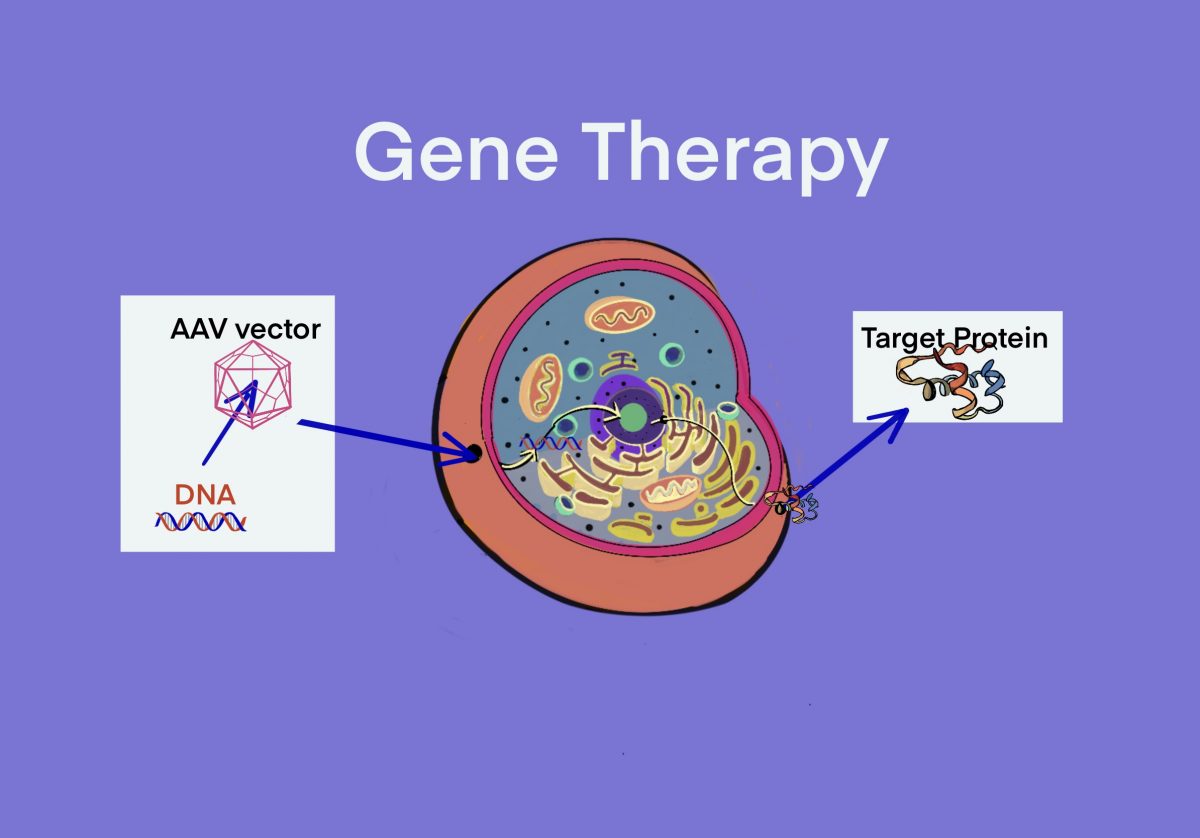
[遺伝子治療] アデノ随伴ウイルス(AAV)ベクターによる遺伝子治療薬 – 学者の承認済み/間近/臨床試験中 – ID1124 [2020/07/17]
Post Views: 445 AAVベクターによる遺伝子治療 2020/7現在、承認及び間近の品目 Zolg…
投稿者