カテゴリー: BIOLOGICS
-
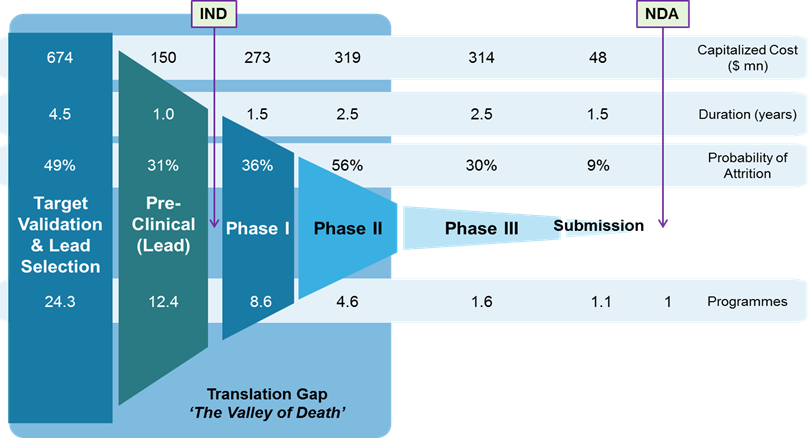
[Bio-Edu] Drug development lifecycle 医薬品の開発ステージ毎の – コスト、期間、次期移行確率 by Lonza – ID8649 [2020/02/05]
Post Views: 649 医薬品の開発 かかるコストについては、プログラム(研究テーマ)当たりで算出した…
投稿者

-
[Bio-Material] Sartobind® Phenyl [2020/02/05]
Post Views: 610 Sartobind Pheny 疎水性クロマト用のメンブラン担体です。レジンを…
投稿者

-
[Bio-Equip] Xuri Cell Expansion System W25 – △ID8624 [2020/02/05]
Post Views: 616 Xuri Cell Expansion System W25 Cytiva社製…
投稿者

-
[Bio-Lab] Empty Column, PD-10/自分で充填するスペシャルなPD-10カラムの使い方 – Rapid Purification – カラム精製システムは不要 – ID8584
Post Views: 886 安価にカラム精製を行う Mr.HARIKIRIからお届けするPD-10 Emp…
投稿者

-
[Bio-Equip] Glass Empty Columns [2020/02/04]
Post Views: 616 Empty Glass Column クリニカル(臨床)用のタンパク質生成に使…
投稿者

-
[Bio-Lab] Slide-A-Lyzer™ Dialysis Cassette – タンパク質サンプルのバッファー置換 – 昔は、透析チューブを使っていたが今はバカチョン – ID8580 [2020/09/16]
Post Views: 805 Slide-A-Lyzer ラボスケール用の透析用膜キットです。昔は、ロールの…
投稿者

-
[Bio-Reagent] ドデシルトリメチルアンモニウムクロリド (DTAC) – 細胞膜タンパク質の溶解 [2020/02/04]
Post Views: 623 分類 界面活性剤 用途 細胞の膜タンパク質の溶解 物性 陽イオン性、分子量 2…
投稿者